Анна Ильющенкова
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Республика Адыгея
В рамках национального проекта «Борьба с сердечно-сосудистыми заболеваниями» для Майкопской городской клинической больницы было закуплено новое оборудование, а именно:
- функциональные кровати 60шт.;
- подъёмник для больных 2шт.;
- комплект мягких модулей для зала лечебной физкультуры;
- стабилоплатформа с биологической обратной связью;
- аппарат ИВЛ 2 шт.;
- передвижной ультразвуковой аппарат для исследования сердца и сосудов.
Оборудование закуплено на сумму около 21 млн. рублей.
В настоящее время оборудование установлено в отделении анестезиологии и реанимации инфекционного госпиталя Майкопской городской клинической больницы для лечения больных с коронавирусом.
Появление компьютерного томографа позволит ускорить процесс диагностики и устранит сроки ожидания пациентами КТ-исследований.
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Омская область
18 мая состоялась первая онлайн конференция «Manage Pain Digital»/Управляй болью. Мероприятие с участием ведущих зарубежных и российских спикеров прошло в режиме реального времени.
От ОмГМУ в большом образовательном проекте принял участие д.м.н. профессор, заведующий кафедрой неврологии ДПО ОмГМУ, член правления Всероссийского общества неврологов, Председатель Правления Омского общества и нейрохирургов им. династии Савченко А.С.Рождественский. Конференция длилась с 8 до 14 часов (по МСК). Шестичасовой научный марафон был адресован для врачей всей Сибири и проводился по приглашению Первого Московского государственного медицинского университета имени И. М. Сеченова.
На открытии встречи выступил Президент Международного Института боли Джустино Варрасси (Италия). Работа конференции была разбита по семи тематическим блокам. В фокусе внимания специалистов оказался широкий спектр вопросов, в том числе по поводу мигрени и новых возможностей ее лечения и профилактики, боли в спине, болевой полинейропатии, нелекарственных методах управления болью. В числе спикеров – эксперты из Москвы, Томска, Новосибирска, Красноярска, Алтайского края, Омска. Так от ОмГМУ с лекцией «Остеопатия: организационный и клинический аспекты» и разбором клинического случая выступил д.м.н. профессор, заведующий кафедрой неврологии ДПО ОмГМУ, член правления Всероссийского общества неврологов, Председатель Правления Омского общества и нейрохирургов им. династии Савченко А.С.Рождественский.
По итогам встречи каждый участник помимо опыта и знаний, получил: рецепты противоболевой диеты, музыкальную подборку для управления болью, доступ к записи конференции и другим цифровым обучающим материалам проекта «Manage Pain Personalized Project.
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Ханты-Мансийский Автономный Округ – Югра
В травматологической больнице Сургута устанавливают современный нейроэндоскоп, который позволит проводить нейрохирургам малоинвазивные операции на головном мозге, делая разрез рабочей области не более пяти миллиметров. Электронно-оптический комплекс дает возможность максимального обзора анатомии мозга в 3D-формате во время вмешательства, чего не обеспечивает стандартный хирургический микроскоп.
«Нейроэндоскоп значительно расширит оперативные возможности врачей, - прокомментировал исполняющий обязанности заместителя главного врача БУ «Сургутская клиническая травматологическая больница» Роман Касич. – Важное преимущество новой установки в том, что она имеет специальную комплектацию для педиатрической нейрохирургии. Теперь многие сложные операции детям, даже младенцам первых дней жизни будут проводиться с применением нового оборудования. Как правило, это пациенты с гидроцефалией, внутрижелудочковыми кровоизлияниями и опухолями головного мозга. Визуальный контроль необходим при хирургическом удалении кист или опухолей, создании доступов к гипофизу или основанию черепа».
Новый нейроэндоскоп оснащен механическим фиксатором руки хирурга, который крепится к операционному столу, он исключает малейшие колебания в ходе вмешательства. «Механическая рука» особенно важна для длительных операций, существенно облегчая нагрузку на врача.
«Новая установка имеет множество усовершенствованных функций, дополнительно она может создавать цифровую видеосеть для работы в режиме онлайн, архивировать изображения, проводить моделирование снимков»,- добавил Роман Касич.
В настоящее время в больнице проходит монтаж нового оборудования, дооснащение операционного блока. Планируется, что первые вмешательства на головном мозге с использованием нового эндоскопа проведут уже в июле этого года.
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
9 июня 2020 года состоится онлайн-вебинар по неврологии «Что лечит быстрее, чем время? Своевременный вклад противовоспалительных препаратов при болевом синдроме». Начало научной программы – в 15 часов. К участию в вебинаре приглашаются неврологи, ревматологи, ортопеды и врачи смежных специальностей.
Организаторы мероприятия:
- АНО «Персонализированная медицина»;
- Технический организатор – ООО «Интегрити».
С лекциями на вебинаре выступят Евгения Викторовна Екушева (д.м.н., профессор кафедры нервных болезней АПО ФГБУ ФНКЦ) и Михаил Анатольевич Еремушкин (д.м.н., профессор, глав. науч. сотр., зав. отд. ортопедии, биомеханики, кинезитерапии и мануальной терапии ФГБУ «НМИЦ реабилитации и курортологии» МЗ РФ).
Зарегистрироваться на вебинар можно на сайте: med-marketing.ru/2020-1659.html
Джанелидзевские чтения
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
8 - 11 сентября 2020 года состоится Межрегиональная научно-практическая конференция с международным участием «VII Санкт-Петербургский Септический форум-2020» и Межрегиональная научно-практическая конференция «Джанелидзевские чтения».
Место проведения: гостиница «Санкт-Петербург» по адресу: Пироговская наб., д. 5/2, г. Санкт-Петербург.
Организаторы:
- Комитет по здравоохранению Правительства Санкт-Петербурга,
- Территориальный фонд обязательного медицинского страхования Санкт-Петербурга,
- Санкт-Петербургский научно-исследовательский институт скорой помощи имени И.И. Джанелидзе,
- РОО «Санкт-Петербургское общество специалистов по сепсису»
Сайт мероприятия: congress-ph.ru/event/sepsis20
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Вчера на площадке Международной московской онлайн-Конференции «Аутизм: вызовы и решения»-2020 состоялась одна из ключевых открытых дискуссий, посвященная новой редакции Клинических рекомендаций при расстройстве аутического спектра (РАС). В диалоге участвовали официальные представители российских министерств и ведомств, курирующих образование, медицину, социальную политику РФ, парламентарии, эксперты системной и независимой психиатрии, а также представители российского родительского аутического сообщества и профильных НКО. Горячее обсуждение двух версий документа – под редакцией официальной рабочей группы Минздрава РФ и от альтернативной группы независимых психиатров - остается для всего профессионального и пациентского сообщества актуальным, не смотря на неожиданную Короновирусную пандемию. Каждая из версий Рекомендаций активно обсуждается - насколько качество официального документа повлияет на поведение врачей-психиатров, так сказать, «на местах». С самого начала активного диалога стало понятно, что профильное медицинское сообщество больше волнует бюрократические нормы и нюансы междисциплинарной и межотраслевой коллаборации, зон ответственности и документооборот. Звучали достаточно скучные обсуждения повсеместных бюрократических барьеров - невозможности изменить ситуацию в регионах и российских реалиях уровня зарплат врачей-психиатров, подготовки будущих медицинских специалистов. «Мы против такой безысходности»,- так обозначила модератор сессии свою личную позицию и мнение других участников, направив диалог в конструктивное русло. «Как практикующий специалист, работающий именно в психиатрическом и педиатрическом отделении, вижу, насколько важен консенсус между психиатром и педиатром»,- отметила Наталья Устинова, доктором медицинских наук, врач-психиатр и руководитель отдела социальной педиатрии и организации мультидисциплинарного сопровождения НИИ педиатрии и охраны здоровья детей ЦКБ РАН. Именно она зачитала письмо-обращение от Союза педиатров России к рабочим группам, разработавшим новые проекты Клинических рекомендаций при РАС, в котором обозначила готовность педиатрического сообщества к участию в разработке нового документа и включению в мультидисциплинарное сопровождение пациентов с РАС. «Педиатрическое включение должно быть значительно расширено для того, чтобы оказать полноценную помощь в долгосрочном сопровождении таких детей. Педиатры выходят из зоны комфорта, «забираясь» на новые для себя территории, но они готовы отвечать новым веяниям времени»,- отметил эксперт. «Я абсолютно согласна, что для всех специалистов и медицинского и образовательного профиля, кто встречается с ребенком с аутизмом в своей практике, для оказания ему действенной помощи обязательно должны быть единые методические материалы. Но, если мы говорим о здравоохранении, клинические рекомендации должны быть объединены, т.е. у каждого медицинского специалиста должно быть общее представление о том, что он делает», - так обозначила свою позицию Наталья Устинова по параметрам необходимым для успешного междисциплинарного взаимодействия в сопровождении людей с РАС и их семей.
В свою очередь, представители родительского пациентского сообщества – активного участника дискуссии, обозначили не только важность целостного понимания нового официального документа, но и потребовали кардинальных изменении общего подхода к диагностике и выявлению природы диагноза РАС. Главной целью объединения усилий специалистов всех уровней, по их мнению, должен стать сам ребенок с РАС и его семья, его благополучие, а также устранение "дефицитов" каждого отдельного особенного ребенка в медицинской и социальной поддержке, воспитании, образовании, социализации и последующей полноценной жизни такого человека в современной России.
Пока же родительское сообщество детей с РАС может говорить только о том, что врач-психиатр должен стать Мета-фигурой, объединяющей все знания об аутизме, обладающей четким пониманием инструментов и этапов адаптации, медицинской поддержки и эффективности инклюзивных методик таких детей на ранних этапах диагностики. Он должен, в первую очередь, нести ответственность за правильный выбор маршрута ребенка с аутизмом и целого ряда решений, влияющих на его будущее. Необходим запрет на «снобизм» со стороны специалиста к мнению семьи особого ребенка и взгляд в сторону усиления поддержки и взаимопонимания с родителями детей с особенностями развития – ведь именно они представляют всю полноту интересов пациента с РАС. По их мнению, в большинстве своем, российское психиатрическое сообщество пока стоит "спиной к мировой науке и ее достижениям". «Мы активно наблюдаем за текущей ситуацией в детской психиатрии по всей стране и видим, что за последние годы она так и не приблизилась к точному пониманию природы, симптоматики и основных характеристик расстройств аутического спектра. От наших практикующих психиатров нет запроса к мировому сообществу на новые методы и разработки»,- констатируют некоторые члены сообщества. «Связка между психиатрией и образованием должна выражаться в том, что психиатры больше погружаются в те образовательные методики, которые по-настоящему помогают людям с РАС. Мы хотим, чтобы психиатрическая помощь сводилась к доказательной коррекции, а не только к психофармакологии», - отметили представители региональных родительских и пациентских ассоциаций. Как известно из последних международных исследований, поведенческая коррекционная методика окончательно доказала свою действенность, а прикладные практики по всему миру показывают высокую эффективность опробованных методик обучения навыкам детей с РАС приемлемому социальному поведению – эти показатели не идут ни в какое сравнение с часто используемой, преимущественно только в российской практике, врачами-психиатрами исключительно медикаментозной поддержки на основе нейролептиков. Во время дискуссии родительская общественность обратилась к представителям Министерства просвещения РФ с просьбой более активно развивать инклюзию, более четко определить инструменты защиты прав на образование и сдвинуть их в сторону индивидуализации образовательных условий. Как они считают, «именно они вместе с инклюзивными условиями максимально терапевтичны и помогают людям с аутизмом на сегодняшний день в большей мере».
Как известно, новейшие научные данные от целого ряда мировых экспертов по изучению проблем аутизма подтверждают важную роль и значимость междисциплинарного подхода и альянса между психиатрией и образованием, качественной ранней помощи и вмешательства, охраны психического здоровья и грамотной психолого-педагогической поддержки детей с РАС. Данные вопросы были широко освещены в рамках VIII Международной научно-практической конференции «Аутизм. Вызовы и решения», в этом году прошедшей впервые в формате онлайн-марафона с 22 апреля по 25 мая. Как обозначила Екатерина Мень, президент Центра проблем аутизма (ЦПА), со-организатор ежегодной Конференции: «Наше событие стало не только интенсивным месячным университетом с уникальным междисциплинарным подходом для всех участников, а это, как растущие с каждым годом российские профессиональные медицинское и учительское сообщества, так и родительская пациентская общественность. В этом году нам удалось собрать на своей платформе более 2000 слушателей практически из всех регионов России и более чем из 15 стран мира, услышать порядка 50 докладов от лекторов из самых разных уголков планеты, все они прошли в рамках 12 тематических блоков, 4 мастер-классов и открытых дискуссионных панелей. Многие доклады по инновационным открытиям в области генетики, связей аутизма и экологии, актуальной сейчас работы на сервисах телемедицины, поддержки и обучения детей с РАС через дистанционные формы, организации жизни с особенными детьми на карантине. Безусловно, большой интерес вызвали доклады по ряду мультидисциплинарных подходов к проблемам доказательных практик в медицинской поддержек детей с РАС и теме «аутизма и интеллекта». Стоит отметить сессию, посвященную изучению особенностей питания детей с аутизмом. Помимо выступлений известных международных практиков в этой области, блестящим стал методологический симбиоз прикладных методик адаптации рациона питания детей с РАС в России от ведущих отечественных экспертов-гастроэнтерологов. Отмечу, что наше онлайн-событие имело четкую драматургию- мы последовательно двигались от темы к теме, шли "шаг за шагом". Без случайных докладов, в этом году, конференция была проведена как целостная программа сессий, рассматривающих аутизм с совершенно разных сторон, в доступной подаче для всех ее участников. И врачи, и педагоги, и родители, смогли проникнуть в содержание каждого доклада и сообщения, возможно, не касающееся напрямую их сферы деятельности, но представляющих для них большой интерес. Мы видели, что врачам интересно слушать все, что связано с образованием детей с аутизмом, а педагогам - различные достижения, мысли, данные, научные открытия о биологических сторонах аутизма и, таким образом, мы смогли комплексно охватить всю проблематику, предоставить заинтересованной междисциплинарной аудитории объемное и максимально актуальное на данный момент знание об аутизме».
Тем временем, общее количество детей с расстройствами аутического спектра во всем мире неуклонно растет. По данным всемирной организации исследований аутизма, за последние годы выявлено более 170 видов расстройств и все они были отнесены к аутическому спектру, количество детей с диагнозом РАС ежегодно растет на 13-17%. Одно из последних глобальных исследований выявило, что люди с РАС умирают не достигнув сорокалетия - средняя продолжительность их жизни составила 39,5 года. Эта абсолютная цифра не оставила равнодушным мировое сообщество и борьба за рост продолжительности жизни стала сегодня общемировым трендом. По словам Агнешки Вронынски, доктора медицинских наук, преподавателя Гданьского медицинского университета (Польша), эксперта мирового уровня по проблеме аутизма и сопутствующим расстройству внутренним болезням, так обозначает текущую общемировую тенденцию: «Профсообщество открыто не только дискутирует с пациентской аудиторией о проблеме, но и, благодаря диалогу, делает первые шаги по объединению совместных усилий, необходимых для срочного снижения смертности. Мы поддерживаем позицию родительского сообщества РАС. Неравноправие и не справедливость в отношении здоровья, неудовлетворенной потребности в медицинском обслуживании людей с аутизмом, еще существуют и их необходимо искоренять».
«Нас тоже «задели за живое» последние данные о продолжительности жизни пациентов с РАС. Все мы понимаем, что умирают эти пациенты в таком раннем возрасте вовсе не от аутизма, а от сопутствующих расстройств, они умирают от того, что у них не устроена жизнь. Мы больше не имеем права, как профессионалы, не думать об этом при сопровождении и поддержке пациентов с РАС. В клинических рекомендациях мы не можем говорить только об узких психиатрических вопросов, только упоминать генетику, но и о психосоматических заболеваниях, которые всегда сопровождают это расстройство. В комплексе, мы также должны говорить образовании - это все должно быть в поле зрении и психиатра, и специалиста, который сопровождает ребенка с РАС. И когда наш психиатр говорит, что «это» (дополнительные аспекты здоровья) будет перегружать клинические знание об расстройстве аутического спектра, мне хочется спросить почему и на каких доказательных данных строится его утверждение, если сейчас все современные требования к практикующим психиатрам, включая международные стандарты, понимать, что на развитие особенных детей влияет большое количество факторов и не учитывать их компетентный специалист не имеет права»,- прокомментировала ситуацию Наталья Устинова, спикер дискуссии – представитель отечественного передового междисциплинарного медицинского сообщества.
По мнению всех участников круглого стола, Россия же, находясь в авангарде общемировых тенденций, не может быть "отрезана" от этой проблемы. Представители родительского сообщества детей с РАС и профильные НКО просят государство не только присоединиться к международным стандартам классификации диагнозов в зоне аутического спектра, но и взять под личный контроль актуализацию сбора последних статистических данных по количеству диагностированных людей с РАС во всех регионах страны.
«Защита и благополучие людей с РАС и их семьи» должна стать новой «государственной политикой» с обязательным выходом человека с особенностями развития на благополучие в течение всей его жизни», - с таким предложением к руководству страны обратился модератор и организатор Дискуссионной панели Елена Клочко, Председатель Совета ВОРДИ, член Совета по вопросам попечительства в социальной сфере при Правительстве РФ.
Запрос от сообщества был услышан и уже в начале этой осени на площадке Совета Федерации, пройдет круглый стол, посвященный проблематике аутизма в РФ с участием всех сторон, кто принял участие в прошедшей диалоговой панели. В резолютивной части по окончанию дискуссии, было отражено, что для дальнейшего конструктивного обращения к целостному пониманию нового документа и внедрению разработок Рекомендаций, в первую очередь, нельзя исключать из диалога пациентское сообщество. Со всей очевидностью можно сказать, что усилиями только одного цеха «реальную помощь» детям с особенностями развития и их семьям построить невозможно. А это значит, в лечебном сообществе, оказывающем медицинскую помощь людям с РАС, тоже должна возникнуть междисциплинарность. При уважении к традиции и опыту отечественных специалистов в области психиатрии и других врачебных практик, необходимо опираться на объективную науку. Для осуществления уже в ближайшее время настоящего «прорыв в будущее», стоит использовать уже действующие НКО, родительские ассоциации и объединения федерального и регионального уровней. Именно они, уже накопившие определенный социально-практический опыт активной деятельности, с пулом реализованных программ реальной поддержки детей с аутистическими расстройствами, смогут стать тем необходимым сейчас «мостиком», который поможет «расшевелить» профильное медицинское, в первую очередь, ставшее ригидным сообщество практикующих психиатров, подтолкнуть к конкретным действиям.
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Уважаемые читатели,
в разделе Публикации Невроньюс, Главная тема, размещена статья "Временные рекомендации по ведению пациентов с заболеваниями и травмами нервной системы при COVID-19".
Соавторы: Литвиненко И.В., Одинак М.М., Емелин А.Ю., Базилевич С.Н., Голохвастов С.Ю., Красаков И.В., Лобзин В.Ю., Наумов К.М., Прокудин М.Ю., Самарцев И.Н., Скулябин Д.И., Труфанов А.Г., Цыган Н.В., Янишевский С.Н.
НЕВРОНЬЮС №4, апрель 2020
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
НЕВРОНЬЮС №3, март 2020
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Временные рекомендации по ведению пациентов с заболеваниями и травмами нервной системы при COVID-19
Сайт НЕВРОНЬЮС, который Вы собираетесь посетить, содержит материалы исключительно для работников здравоохранения. Нажимая на кнопку «Войти» Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Литвиненко И.В., Одинак М.М., Емелин А.Ю., Базилевич С.Н., Голохвастов С.Ю., Красаков И.В., Лобзин В.Ю., Наумов К.М., Прокудин М.Ю., Самарцев И.Н., Скулябин Д.И., Труфанов А.Г., Цыган Н.В., Янишевский С.Н.
Неврологические симптомы COVID-19
По данным Mao L. et al. (2020), в Китае по результатам обследования 214 пациентов с COVID-19 неврологические симптомы были выявлены у 36,4% пациентов с COVID-19, проходящих стационарное лечение по поводу тяжелого острого респираторного синдрома. Неврологические симптомы включали:
- симптомы поражения центральной нервной системы (головокружение, головная боль, угнетение или изменение сознания, атаксия, судороги, а также клиническая и инструментальная картина острого нарушения мозгового кровообращения) – 53 (24,8%) случая;
- симптомы поражения периферической нервной системы (нарушение вкуса, нарушение обоняния, нарушение зрения, болевой синдром) – 19 (8,9%) случаев;
- симптомы поражения скелетно-мышечной системы (боль в мышцах в сочетании с повышением уровня креатинфосфокиназы) – 23 (10,7%) случая.
Наиболее частыми симптомами были головокружение (16,8%), головная боль (13,1%), нарушение вкуса (5,6%), нарушение обоняния (5,1%). Признаки поражения нервной системы наблюдались чаще при тяжелом течении COVID-19 по сравнению с легким течением (45,5% и 30,2% соответственно). Все неврологические симптомы (за исключением клинической и инструментальной картины острого нарушения мозгового кровообращения) появлялись на ранней стадии заболевания, в среднем, на 1-2 день заболевания.
Пациенты с более тяжелым течением коронавирусной инфекции имеют большее количество сосудистых факторов риска и, в особенности, более высокую частоту артериальной гипертензии, что вполне может определять церебральную симптоматику. По данным Chen T. et al. (2020), в Китае по результатам прижизненного обследования 113 умерших пациентов с COVID-19 22% имели угнетение сознания (от оглушения до глубокой комы) в отличие от всего лишь 1% случаев нарушения сознания у в последующем выздоровевших пациентов с COVID-19. Таким образом, нарушение сознания на любом этапе заболевания COVID-19 – это прогностически неблагоприятный фактор его течения.
Стойкое нарушение обоняния редко встречается при острых респираторных заболеваниях, однако сравнительно часто возникает при COVID-19. По данным Bagheri S.H.R. et al. (2020), в Иране по результатам дистанционного обследования 15.228 пациентов с COVID-19 частота гипосмии и аносмии составила 67,3% (из них у 60,9% нарушение обоняния сохранялось в течение более чем 1 месяца), 83% пациентов с нарушением обоняния также предъявляли жалобу на нарушение вкуса (гипогевзию или агевзию). Нарушения обоняния и вкуса могут корреспондировать с наличием воспалительного поражения верхних дыхательных путей в виде ринофарингита. По данным ряда авторов, обонятельные рецепторы, луковицы и тракт могут быть входными воротами для COVID-19 и его последующего проникновения в головной мозг.
1. Поражение головного мозга при COVID-19: энцефалит и энцефалопатия
В конце марта в журнале Radiology впервые описано поражение головного мозга при COVID-19 в виде острой геморрагической некротизирующей энцефалопатии (Poyiadji N. et al., 2020). Однако развитие этого заболевания вполне вероятно не связано с возможной нейротропностью вируса, поскольку может наблюдаться и при гриппе, кори, краснухе, других вирусных инфекциях и обусловлено повреждением нейрососудистой единицы при «цитокиновом шторме». Вместе с тем, описанный клинический случай явно свидетельствует о возможности очагового поражения головного мозга при COVID-19. По данным компьютерной томографии (КТ) головы и магнитно-резонансной томографии (МРТ) головного мозга выявлено симметричное поражение зрительных бугров, медиальных и медио-базальных отделов височных долей, в том числе на Т2-FLAIR и SWI-последовательностях (рис. 1), а также кольцевидное накопление контрастного вещества, свидетельствующее о локальном повреждении гематоэнцефалического барьера.
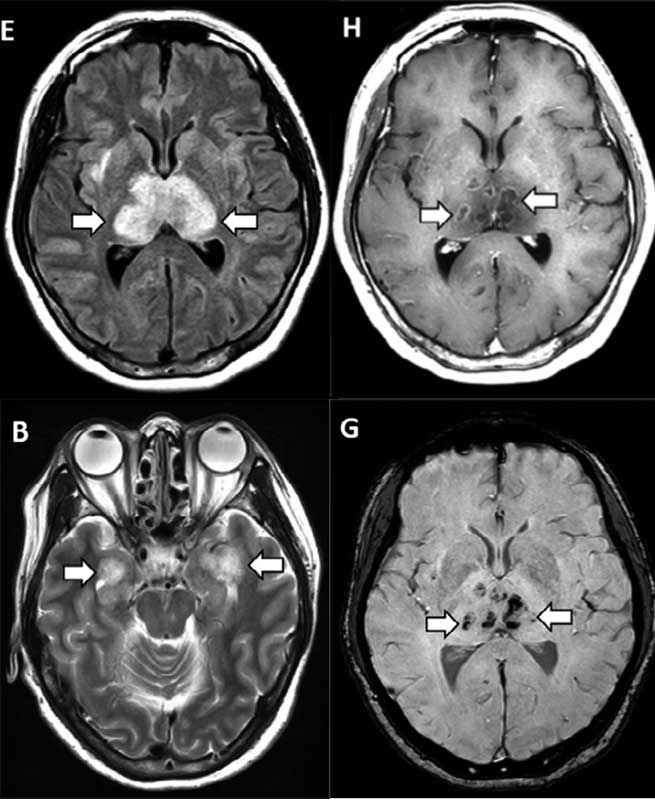
Рис. 1. Магнитно-резонансные томограммы головного мозга пациентки (в возрасте 50 лет) с COVID-19. T2-FLAIR (B, E), постконтрастное изображение (H), SWI (G) свидетельствуют о геморрагическом повреждении зрительных бугров, височных долей.
Вместе с тем, исследователи из Ирана также опубликовали клиническое наблюдение пациента с COVID-19 с геморрагическим мозговым инсультом (Sharifi-Razavi A. et al., 2020). В качестве возможного механизма развития геморрагии в таком случае можно было бы рассматривать широкую представленность рецепторов ангиотензин-превращающего фермента 2 типа (АПФ-2), являющихся «входными воротами» для вируса COVID-19 в эндотелии и нейроэпителиальных клетках, наряду с альвеолярными клетками.
Японскими исследователями Moriguchi T. et al (2020) представлено наблюдение случая менингоэнцефалита, ассоциированного с COVID-19, у 24-летнего мужчины. Заболевание дебютировало с угнетения сознания и судорожного синдрома. В цереброспинальной жидкости отмечен лимфоцитарный плеоцитоз 12х109/л, при вирусологическом анализе из ликвора был выделен COVID-19, другие инфекционные агенты не были обнаружены. При проведении МР-исследования на DWI-изображениях выявлены гиперинтенсивные изменения стенки нижнего рога правого бокового желудочка, на FLAIR-изображениях – гиперинтенсивность в проекции правого гиппокампа, а также признаки пансинусита на Т2-ВИ (рис. 2). Кроме того, следует обратить внимание и на то, что вирусологическое исследование материала, полученного при назофарингеальном соскобе, также не определило COVID-19. Вместе с тем, дебют заболевания с генерализованного судорожного приступа, на наш взгляд, может быть объяснен и имеющейся субатрофией гиппокампа у пациента с впервые выявленным склерозом гиппокампа, как формой височной эпилепсии, а гиперинтенсивность сигнала может рассматриваться как постприступные изменения, что требует, безусловно, дальнейшего изучения.
Общемозговая симптоматика, такая как головная боль, тошнота, а также и когнитивные нарушения у пациентов с COVID-19 вместе с тем, могут быть проявлением не прямого поражения головного мозга, а опосредованного – связанного с развитием гипоксии. В таком случае, вышеуказанные неврологические проявления можно рассматривать как гипоксическую энцефалопатию при COVID-19, однако это требует исследования в отсроченном периоде наблюдения за реконвалесцентами.
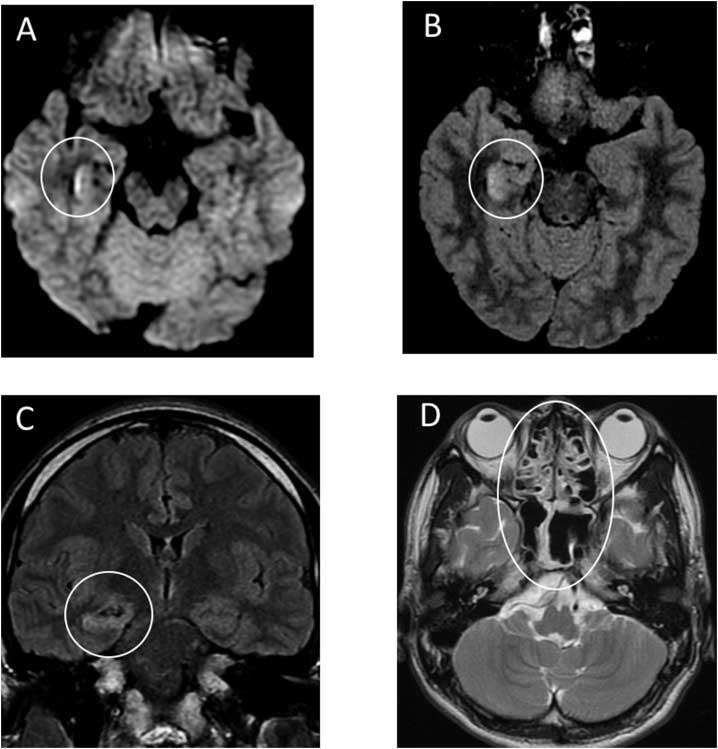
Рис. 2. МРТ головного мозга мужчины (в возрасте 24 лет) с COVID-19 с эпизодом спутанности и судорожным синдромом (анализ ликвора на COVID-19 положительный). А: DWI, гиперинтенсивность стенки нижнего рога правого бокового желудочка; B, C: FLAIR, гиперинтенсивный МР-сигнал в проекции правой медиальной височной доли и гиппокампа с сопутствующей субатрофией гиппокампа; D, Т2-ВИ, признаки пансинусита.
Таким образом, всем пациентам с подтвержденным COVID-19 или с подозрением на COVID-19 при развитии судорожного синдрома, угнетения или изменения сознания, появления новой очаговой неврологической симптоматики показано выполнение МРТ головного мозга (Т2, FLAIR, SWI, с контрастированием; при невозможности выполнения МРТ – КТ головы), исследования цереброспинальной жидкости (ПЦР) на носительство COVID-19.
2. Острое нарушение мозгового кровообращения у пациентов с COVID-19
2.1. Все пациенты с острым нарушением мозгового кровообращения ОНМК (до получения отрицательных результатов исследования на COVID-19) должны рассматриваться как потенциально инфицированные или болеющие COVID-19.
2.2. Все пациенты с ОНМК должны поступать по единой схеме медицинской сортировки в приемном отделении, предполагающей соблюдение противоэпидемического режима, не следует госпитализировать пациентов с признаками ОНМК минуя приемное отделение.
2.3. Внутригоспитальная маршрутизация пациентов должна осуществляться в соответствии со схемой, предполагающей противоэпидемический режим, принятый к исполнению в учреждении. В неперепрофилированных под COVID-19 сосудистых центрах целесообразно предусмотреть разделение коек для пациентов с ОНМК на два потока – «доказано отсутствие COVID-19» (наиболее вероятно – внутригоспитальные инсульты) и «возможно COVID-19» (наиболее вероятно – внегоспитальные инсульты); персонал, работающих в этих отделениях следует разделять для предотвращения перекрестного заражения.
2.4. Риск развития ишемического инсульта при COVID-19 характерен для коморбидных пациентов с артериальной гипертензией, сахарным диабетом, ишемической болезнью сердца, пациентов старших возрастных групп и связан с формированием микротромбозов на фоне системного воспаления. Вероятность летального исхода у пациентов с инсультом на фоне тяжелого течения COVID-19 обусловлена общебиологическими причинами.
2.5. Согласно диагностическим и лечебным алгоритмам у пациентов с признаками ОНМК при COVID-19 рекомендовано:
- брать материал для исследования на COVID-19 при поступлении;
- собирать анамнез в случае нарушенных сознания или функции речи с использованием средств телекоммуникации с родственниками или совместно проживающими лицами;
- совместно выполнять КТ головы и КТ органов грудной клетки при наличии клинических данных, указывающих на проявления острой респираторной инфекции, в т.ч. COVID-19 или пневмонию;
- выполнять КТ-ангиографию сосудов шеи и головы при наличии клинического подозрения на тромбоз проксимального отдела мозговой артерии (в случае выполнения КТ-ангиографии сосудов шеи и головы выполнение первичного ультразвукового исследования сосудов шеи и головы необязательно);
- при наличии показаний и отсутствии противопоказаний рекомендовано начинать системную тромболитическую терапию после КТ головы, не дожидаясь выполнения других диагностических процедур;
- доза и тактика введения тромболитика определяются в соответствии с принятыми стандартами оказания помощи пациентам с ишемическим инсультом;
- с целью снижения эпидемических рисков допускается выполнение системной тромболитической терапии в непрофильных для лечения ОНМК подразделениях стационара под дистанционным телемедицинским контролем невролога;
- при выполнении процедур по оценке глотания и проходимости дыхательных путей, постановка зонда, интубации трахеи требуется использование персоналом средств индивидуальной защиты 3-го уровня.
2.6. Совместное использование противовирусной терапии лопинавир + ритонавир у пациентов с COVID-19 изменяет активность системы цитохромов печени и поэтому предполагает следующие ограничения применения медикаментозной терапии в остром периоде ОНМК:
- новые оральные антикоагулянты – отмена (в соответствии с инструкцией к препарату ритонавир) или снижение дозы на 50%;
- варфарин – ежедневный контроль международного нормализованного отношения (МНО) и коррекция дозы по МНО;
- при необходимости использования антикоагулянтов предпочтение отдавать нефракционированному гепарину или низкомолекулярным гепаринам;
- если пациент нуждается в базовой антиагрегантной терапии для вторичной профилактики инсульта, рекомендовано применение ацетилсалициловой кислоты в стандартных дозах;
- использование клопидогрела или тикагрелора не рекомендовано вследствие изменения их метаболизма, прасугрел не рекомендован пациентам с инсультом или транзиторной ишемической атакой в анамнезе;
- противопоказано назначение карбамазепина, фенобарбитала, фенитоина, кветиапина.
2.7. Специализированная медицинская помощь (СМП) при остром нарушении мозгового кровообращения у пациента с COVID-19 должна быть оказана в соответствии с приказом МЗ РФ № 928н (2012 г.) с учетом ряда особенностей:
- пациенты с ишемическим мозговым инсультом, нуждающиеся в эндоваскулярном лечении при отсутствии противопоказаний, должны быть подвергнуты внутрисосудистой тромбэктомии с соблюдением санитарно-эпидемических требований (в условиях общей анестезии и интубации трахеи для всех пациентов, операционные с «отрицательным давлением»);
- при наличии выраженной дыхательной недостаточности, требующей искусственной вентиляция легких, или декомпенсации гемодинамики (системное артериальное давление менее 80 мм рт. ст.) у пациента с COVID-19 и ОНМК принятие решения о проведении реперфузионной терапии откладывается до стабилизации состояния;
- в отделении интенсивной терапии в первые сутки измерять пациентам температуру тела 6 раз в день (по частоте осмотров неврологом и реаниматологом), после перевода в отделение – 3 раза в день;
- рассмотреть возможность сокращения времени лечения и наблюдения за пациентами в отделении интенсивной терапии при стабилизации состояния, верификации патогенетического подтипа инсульта, легкой степени тяжести инсульта (до 8 баллов по шкале NIHSS) и отсутствии декомпенсации фоновых и сопутствующих заболеваний;
- при появлении у пациентов с ОНМК, получающих лечение в ОРИТ или в неврологическом отделении, симптоматики острой респираторной инфекции (ринит, сухой кашель, боль в горле), повышении температуры тела более 37,5°С следует выполнить повторный анализ на COVID-19 (мазок), КТ легких, клинический и биохимический анализы крови;
- мероприятия реабилитации в остром периоде для пациентов с ОНМК и признаками респираторной инфекции или имевших контакт с пациентами с COVID-19 следует ограничить палатой пребывания пациента;
- пациенты с малым и неинвалидизирующим неврологическим дефицитом (0-2 балла по модифицированной шкале Рэнкин, более 8 баллов по шкале Ривермид) могут рассматриваться как кандидаты для более раннего перевода на дальнейшие этапы реабилитации;
- все пациенты, имеющие выраженные общемозговые симптомы (головная боль, головокружение, психомоторное возбуждение, рвота, нарушение сознания), менингеальные симптомы, остро развившиеся очаговые неврологические симптомы на фоне фебрильной температуры и респираторных симптомов должны быть обследованы на возможные менингит и энцефалит, им должны быть выполнена люмбальная пункция с исследованием ликвора на содержание белка, глюкозы (параллельно с плазмой крови), оценкой клеточного состава ликвора, а также КТ легких.
3. Эпилепсия у пациентов с COVID-19
В настоящее время отсутствуют рекомендации по ведению пациентов с COVID-19 и эпилепсией.
Развитие эпилептического приступа, а также наиболее грозного осложнения, эпилептического статуса, может быть следствием декомпенсации течения основного заболевания (эпилепсии в анамнезе), а также по причине развития энцефалита, связанного с COVID-19, тяжелых метаболических нарушений (остро возникший симптоматический эпилептический приступ/статус).
Причинами учащения приступов у пациентов с эпилепсией могут выступать интоксикация, гипертермия, нарушение режима приема антиэпилептических препаратов, особенно у пациентов с тяжелыми формами COVID-19 с нарушением сознания, нахождением на ИВЛ, фармакокинетическое и фармакодинамическое взаимодействие антиэпилептических препаратов с препаратами, используемыми при лечении COVID-19, «проконвульсивный» эффект некоторых антибактериальных препаратов.
Регулярная термометрия пациентам с COVID-19 обязательна. К сожалению, на сегодняшний день эксперты не смогли достичь согласия в вопросе, какая пороговая температура тела может рассматриваться в качестве причины судорог. Наиболее приемлемым для всех оказалась следующая тактика: пороговую температуру тела определяют индивидуально, исходя из анамнестических данных и клинических проявлений (Курбанова Ш.Б. с соавт., 2015; Commission on Epidemiology and Prognosis, 1993). Жаропонижающим препаратом первого выбора является парацетамол, который назначается по 500 мг до 4 раз в день (максимальна доза: разовая – 1 г, суточная – 4 г). При одновременном применении с карбамазепином, фенитоином, фенобарбиталом, примидоном уменьшается эффективность парацетамола, что обусловлено повышением его метаболизма (процессов глюкуронизации и окисления) и выведения из организма.
У пациентов с эпилепсией рекомендовано выполнение стандартного клинико-лабораторного обследования: общий клинический анализ крови, включающий лейкоцитарную формулу, подсчет тромбоцитов, биохимический анализ крови (АЛТ, АСТ, ЩФ, креатинин, мочевина, билирубин, глюкоза, калий, натрий, хлор, КФК), коагулограмма, общий клинический анализ мочи. Из инструментальных методов диагностики рекомендована электроэнцефалография, МРТ головного мозга или КТ головы.
Основной задачей при лечении пациентов с эпилепсией является сохранение терапии антиэпилептическими препаратами. Изменение терапии антиэпилептическими препаратами должно осуществляться врачом неврологом при условии сохранения/учащения эпилептических приступов, либо развития побочных эффектов.
При невозможности перорального назначение антиэпилептических препаратов вследствие тяжелого течения заболевания (например, нахождение на ИВЛ, нарушение сознания) необходимо продолжить назначение препаратов через зонд, либо переходить на инфузионные формы (табл. 1).
Таблица 1. Внутривенные формы антиэпилептических препаратов
| № п/п | Наименование препарата | Показания | Схема назначения |
| 1 | Вальпроевая кислота (раствор для внутривенного введения, либо лиофилизат д/пригот. р-ра д/в/в введения) | Эпилептический статус. Эпилепсия различной этиологии (идиопатическая, криптогенная, симптоматическая). Генерализованные эпилептические приступы у взрослых и детей (клонические, тонические, тонико-клонические, абсансы, миоклонические, атонические). Парциальные эпилептические приступы у взрослых и детей (с вторичной генерализацией или без нее). Специфические синдромы (Веста, Леннокса-Гасто). Фебрильные судороги у детей. | Препарат применяют для в/в введения. При в/в медленном введении рекомендованная суточная доза составляет 5-10 мг/кг массы тела. При в/в инфузионном введении рекомендованная доза составляет 0.5-1 мг/кг/ч. При переходе с приема внутрь на в/в введение дозы не изменяются, первое в/в введение рекомендуется через 12 ч после последнего приема внутрь. При необходимости быстрого достижения и поддержания высокой концентрации в плазме рекомендуется следующий подход: в/в введение 15 мг/кг за 5 мин, через 30 мин начать инфузию со скоростью 1 мг/кг/ч при постоянном мониторировании концентрации до достижения концентрации в плазме около 75 мкг/мл. Максимальная суточная доза препарата не должна превышать 2500 мг. Средние суточные дозы составляют 20 мг/кг у взрослых и пожилых пациентов, 25 мг/кг - у подростков, 30 мг/кг - у детей. |
| 2 | Леветирацетам |
В качестве монотерапии (препарат первого выбора) при лечении: парциальных приступов с вторичной генерализацией или без таковой у взрослых и подростков старше 16 лет с впервые диагностированной эпилепсией. В составе комплексной терапии при лечении: парциальных приступов с вторичной генерализацией или без таковой у взрослых и детей старше 4 лет с эпилепсией; миоклонических судорог у взрослых и подростков старше 12 лет с ювенильной миоклонической эпилепсией; первично-генерализованных судорожных (тонико-клонических) приступов у взрослых и подростков старше 12 лет с идиопатической генерализованной эпилепсией. |
Препарат вводится в виде инфузий. Переход от перорального к в/в применению и обратно может быть осуществлен с сохранением дозы и кратности введения. Один флакон концентрата для приготовления раствора для инфузий содержит 500 мг леветирацетама (100 мг/мл). Суточную дозу делят на два введения в одинаковой дозе. Перед применением концентрат необходимо разбавить растворителем объемом не менее 100 мл. Вводят в/в капельное течение 15 минут. В качестве растворителей могут использоваться: 0.9% раствор натрия хлорида для инъекций; раствор Рингера лактатный для инъекций; 5% раствор декстрозы для инъекций. Максимальная суточная доза составляет 3000 мг (по 1500 мг×2 раза/сут). |
| 3 | Лакосамид | В составе комплексной терапии парциальных судорожных приступов, сопровождающихся или не сопровождающихся вторичной генерализацией, у пациентов с эпилепсией в возрасте от 16 лет и старше. В виде инфузий назначают в тех случаях, когда временно невозможен прием препарата внутрь | В/в вводят в течение 15-60 мин 2 раза/сут. Рекомендуемая начальная доза составляет 50 мг 2 раза/сут. Через 1 неделю дозу увеличивают до 100 мг 2 раза/сут. С учетом эффективности и переносимости поддерживающую дозу можно увеличивать каждую неделю на 50 мг 2 раза/сут до максимальной суточной дозы 400 мг (по 200 мг 2 раза/сут). При необходимости можно заменять прием таблеток в/в введением без повторного титрования дозы и наоборот. При этом не следует менять суточную дозу и кратность применения (2 раза/сут). |
Важно, что ряд антиэпилептических препаратов несовместим с препаратами, используемыми для лечения COVID-19. По данным Ливерпульской группы по взаимодействию лекарственных препаратов, хлорохин и гидроксихлорохин несовместимы с карбамазепином, фенобарбиталом, фенитоином, примидоном (Мартынов М.Ю. с соавт., 2020). Также необходимо учитывать взаимодействие антиэпилептических препаратов и препаратов, используемых для лечения COVID-19 (табл. 2).
Остро возникшие симптоматические эпилептические приступы (ОВСЭП) — термин, рекомендованный экспертами Международной лиги по борьбе с эпилепсией (2010) для обозначения приступов различной природы, возникающих в тесной временнóй связи с острым повреждением центральной нервной системы (ЦНС), вследствие нарушения обмена веществ, воздействия токсических, инфекционных и воспалительных факторов и структурных повреждений головного мозга (Липатова Л.В., с соавт., 2015; ILAE Commission on Epidemiology, 2010). О данном событии можно говорить в том случае, если оно произошло в течение одной недели после острого повреждения головного мозга, в том числе, вследствие аноксической энцефалопатии, острой нейроинфекции, острого нарушения мозгового кровоообращения, тяжелых метаболических расстройств (в течение 24 ч после зарегистрированных метаболических нарушений), интоксикации лекарственными средствами с проконвульсивным эффектом.
Как следствие, впервые развившийся приступ у пациента с COVID-19 требует диагностического поиска метаболических расстройств и исключение энцефалита, связанного с COVID-19. Для поиска метаболических нарушений обязательным является исследование уровня глюкозы, электролитного баланса, креатинина, мочевины, показателей кислотно-щелочного состояния. Для исключения энцефалита выполнение люмбальной пункции, МРТ головного мозга. В литературе описаны отдельные случаи менингоэнцефалита, связанного с COVID-19, с развитием генерализованного судорожного приступа (Moriguchia T. et al., 2020).
Для купирования остро возникшего эпилептического приступа могут быть использованы производные бензодиазепинов (диазепам), а также внутривенные формы антиэпилептических препаратов. Диазепам вводится 10 мг внутривенно, либо внутримышечно. Максимальная суточная доза составляет 60 мг. Высокая эффективность бензодиазепинов при оказании неотложной помощи не вызывает сомнения, внутривенное применение диазепама позволяет купировать судорожный эпилептический статус в 42,6% случаев, при этом частота осложнений со стороны дыхательной и сердечно-сосудистой систем, послужившая причиной интубации, гипотензии, аритмии, достигает 10,3% случаев (Alldredge B.K. et al., 2001; Одинак М.М. с соавт., 2015). Представляется, что повторное внутривенное введение бензодиазепинов будет приводить к увеличению частоты осложнений.
Таблица 2. Взаимодействие антиэпилептических препаратов и препаратов, используемых для лечения COVID-19
| Лопинавир/ритонавир | Хлорохин | Гидроксихлорохин | Тоцилизумаб | Интерферон бета | |
| Карбамазепин | Снижается воздействие лопинавира/ритонавира, повышается воздействие карбамазепина | Несовместимы | Несовместимы | Снижается воздействие карбамазепина | Отсутствует взаимодействие |
| Клоназепам | Повышается воздействие клоназепама | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Эсликарбазепин | Снижается воздействие лопинавира/ритонавира | Снижается воздействие хлорохина | Снижается воздействие гидроксихлорохина | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Этосуксимид | Повышается воздействие этосуксимида | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Габапентин | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Лакосамид | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Ламотриджин | Снижается воздействие ламотриджина | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Леветирацетам | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Окскарбазепин | Снижается воздействие лопинавира/ритонавира | Снижается воздействие хлорохина | Снижается воздействие гидроксихлорохина | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Перампанел | Повышается воздействия перампанела | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Фенобарбитал | Снижается воздействие лопинавира/ритонавира | Несовместимы | Несовместимы | Снижается воздействие фенобарбитала | Отсутствует взаимодействие |
| Фенитоин | Снижается воздействие лопинавира/ритонавира | Несовместимы | Несовместимы | Снижается воздействие фенитоина | Отсутствует взаимодействие |
| Прегабалин | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Примидон | Снижается воздействие лопинавира/ритонавира, а также примидона | Несовместимы | Несовместимы | Снижается воздействие примидона | Отсутствует взаимодействие |
| Топирамат | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Вальпроаты | Повышается воздействие лопинавира/ритонавира | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Вигабатрин | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
| Зонисамид | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие | Отсутствует взаимодействие |
Высокая эффективность вальпроатов показана при лечении как судорожного, так бессудорожного эпилептического статусов. В частности, Agarwal P. et al. (2007) в сравнительном исследовании вальпроатов и фенитоина показали высокую эффективность в обоих группах пациентов с достижением контроля над приступами в 88% и 84% случаев соответственно. Системные побочные эффекты со стороны дыхания, сердечно-сосудистой системы не выявлялись. Преимущества вальпроатов для внутривенного введения: 1) отсутствие угнетения дыхательной и сердечной деятельности; 2) отсутствие седативных свойств; 3) быстрое начало действия (3–5 мин); 4) высокая эффективность (80-90% случаев), в частности, при неэффективности диазепама (Одинак М.М. с соавт., 2015). Результаты исследования эффективности вальпроевой кислоты как препарата первой очереди выбора для купирования статуса и серийных приступов на догоспитальном этапе приведены в публикации Карлова В.А. с соавт. (2011). Среди особенностей фармакокинетики следует отметить, что вальпроаты являются ингибиторами микросомальных цитохром-Р-450-зависимых монооксигеназ печени, что может приводить к изменению (как правило, значительному повышению) концентрации других препаратов с печеночным клиренсом. Это необходимо учитывать при назначении антибиотиков, выборе общих анестетиков (в частности, тиопентала натрия) и других препаратов.
Назначение леветирацетама (внутривенной формы) показано при парциальных приступах с вторичной генерализацией или без таковой у взрослых и подростков старше 16 лет. Данная лекарственная форма может использоваться в качестве временной альтернативы при невозможности применения пероральных форм препарата. Официального показания к применению для лечения эпилептического статуса не имеет, однако мировая практика показывает возможность его применения для лечения эпилептического статуса.
Лакосамид (инфузионная форма) используется в составе комплексной терапии парциальных судорожных приступов, сопровождающихся или не сопровождающихся вторичной генерализацией, у пациентов с эпилепсией в возрасте от 16 лет и старше. В виде инфузий лакосамид назначают в тех случаях, когда временно невозможен прием препарата внутрь.
4. Ведение пациентов с болезнью Паркинсона в условиях отделения реанимации и интенсивной терапии при декомпенсации состояния на фоне COVID-19
Необходимые меры при наличии нарушения сознания, признаков нарушения глотания, необходимости проведения длительной анестезии у пациентов с болезнью Паркинсона:
1. Установка назогастрального зонда в кратчайший период. Если позволяет состояние пациента, целесообразна установка гастроюенального чрескожного зонда для введения препаратов леводопы.
2. Коррекция схемы терапии:
2.1. В случае если пациент не получает препаратов леводопы, а находится на терапии другими дофаминергическими препаратами (агонисты дофаминовых рецепторов, ингибиторы МАО, амантадина сульфат/гидрохлорид) или принимает другие формы препаратов леводопы (например, комбинированный препарат леводопа/карбидопа/ энтакапон или формы с медленным высвобождением) следует осуществить перевод пациента на прием препаратов леводопы с пересчетом эквивалентной дозы (табл. 3);
2.2. В случае проведения комбинированной с леводопой противопаркинсонической терапии:
- отмена агонистов дофаминовых рецепторов, ингибиторов МАО, амантадина сульфата/гидрохлорида, комбинированного препарата леводопа/карбидопа/ энтакапон;
- пересчет эквивалентной дозы леводопы отмененным препаратам (см. Табл. 1);
- увеличение дозы леводопы путем добавления к базовой дозе рассчитанной эквивалентной дозы.
Таблица 3. Расчёт эквивалентных леводопе доз дофаминергических препаратов
| Препарат, мг | Коэффициент пересчета при переходе на стандартную форму леводопы |
| Леводопа, форма с контролируемым высвобождением (мадопар ГСС, синемет СР) | × 0,75 |
| леводопа/ карбидопа/энтакапон |
Доза леводопы в составе двухкомпонентного препарата × 1,33 |
| Прамипексол | × 100 |
| Ропинирол | × 20 |
| Разагилин | × 100 |
3. Препараты леводопы вводить в растворенной в 100-200 мл воды форме. Растворение препарата проводить непосредственно перед введением. Наболее удобны диспергируемые формы леводопа/бенсеразид (мадопар). В случае таблетированной лекарственной формы - препарат растолочь; в случае лекарственной формы в виде капсулы – инкапсулят извлечь из капсулы.
4. Минимальная кратность приема препаратов леводопы – 3 раза в день.
5. Введение леводопы через назогастральный зонд следует проводить за 1 час до/через 1 час после введения питания.
6. Обеспечить адекватную перистальтику кишечника, не допускать запоров. Для коррекции запоров рекомендовано применять макрогол.
7. Важным дополнением к терапии является введение раствора амантадина сульфата 500 мл 2-3 раза в день в зависимости от тяжести паркинсонизма.
Особенности выбора лекарственных препаратов для анестезиологического пособия:
- препарат выбора для анестезии – пропофол (противопоказаны – тиопентал, кетамин);
- ограничение ингаляционной анестезии (галотан – сенсибилизация миокарда к катехоламинам, изофлуран – выраженная гипотония);
- при необходимости применения миорелаксантов возможно использование только недеполяризующих – препарат выбора рокуроний. Применение сукцинилхолина не рекомендовано – сообщения о развитии гиперкалиемии при болезни Паркинсона.
Особенности выбора адъювантных лекарственных препаратов (антиэметиков) для анестезиологического пособия:
- рекомендовано применение ондансетрона, в первую очередь, и домперидона, во вторую (риск развития желудочковой аритмии и внезапной сердечной смерти, особенно у лиц старше 65 лет);
- применение метоклопрамида крайне нежелательно;
- производные фенотиазина (аминазин), тиоксантена (хлорпротиксен), бутирофенона (галоперидол, дроперидол) противопоказаны.
Особенности выбора адъювантных лекарственных препаратов (анальгетиков) для анестезиологического пособия:
- препараты выбора – нестероидные противовоспалительные средства (НПВП);
- не рекомендован фентанил (описаны случаи развития тяжелой брадикинезии, не реагирующей на препараты леводопы (купируется с отменой фентанила), а также альфентанил (описаны случаи острой дистонии);
- не рекомендовано применение опиоидных анальгетиков (изменяют экспрессию дофаминовых рецепторов в базальных ганглиях).
Акинетический криз (АК) – резкое нарастание гипокинезии и ригидности с развитием обездвиженности, спутанности сознания, анартрии, нарушения глотания и вегетативных расстройств (тахикардия, артериальная гипотензия, недержание мочи, потоотделение). Для акинетико-гипертермического синдрома (АГС) характерны симптомы акинетического криза, а также гипертермия (гиперпирексия), вызванная дисфункцией гипоталамуса.
К основным причинам развития АК и АГС относятся:
- изменение дофаминергической терапии;
- блокада дофаминергических рецепторов;
- интеркуррентные состояния;
- нарушение работы системы глубокой электростимуляции (при наличии таковой у пациента).
Клиническая картина АГС характеризуется следующими симптомами:
- сроки развития от 18 ч до 7 сут (с момента изменения/прекращения дофаминергической терапии или развития состояния, которое могло спровоцировать декомпенсацию);
- выраженная ригидность/акинезия;
- вегетативные расстройства (тахикардия, тахипноэ, лабильность АД, нарушение мочеиспускания, цианоз, потоотделение);
- через 72-96 ч (в некоторых случаях одновременно с дебютом акинезии) развивается гипертермия (до 41°С);
- нарушение сознания (от возбуждения до оглушения и комы);
- возможно развитие генерализованных тонико-клонических судорог, миоклонии;
- изменение лабораторных показателей: лейкоцитоз, повышение уровня креатинкиназы (260-50000 Ед/л).
Основными осложнениями АК и АГС являются:
- тромбоз глубоких вен;
- эмболия легочной артерии;
- аспирационная пневмония;
- почечная недостаточность.
Мероприятия, проведение которых необходимо при поступлении пациента с акинетическим кризом:
- интубация, проведение ИВЛ (при выраженной дыхательной недостаточности);
- постановка назогастрального зонда, мочевого катетера;
- антибиотикотерапия (в случае выявления инфекционного процесса);
- назначение антипиретиков;
- адекватная инфузионная терапия (коррекция электролитных расстройств);
- гемодиализ (при выявлении почечной недостаточности);
- гепаринотерапия, компрессионный трикотаж (профилактика тромбоза глубоких вен голеней и эмболии легочной артерии);
- позиционирование в кровати (профилактика пролежней).
Основой терапии акинетического криза является восстановление приема дофаминергической терапии в случае ее отмены. Особенности ответа на возобновленную терапию требуют учета следующих аспектов:
- раннее возобновление дофаминергической терапии;
- увеличение исходной дозы дофаминергических препаратов;
- продолжение терапии вне зависимости от наличия ответа (должный ответ может развиться лишь спустя 11 сут);
- невозможность ограничения терапии акинетического криза только дофаминергическими препаратами.
Важным дополнением к терапии является введение раствора амантадина сульфата как препарата, способного снизить активность глутаматной системы, возможно лежащей в основе АГС. Следует придерживаться следующей схемы назначения препарата:
- 500 мл р-ра амантадина сульфата 2-3 раза в день в течение 10-14 дней;
- после завершения курса инфузионной терапии обязателен перевод на пероральную форму в таблетках (300-600 мг/сут).
Тактика коррекции психоза при болезни Паркинсона:
1. Определение причины, провоцирующей психоз (инфекционное заболевание и т.д.), ее коррекция по возможности.
2. Коррекция противопаркинсонической терапии:
2.1. Последовательная отмена препаратов, потенциирующих психотические расстройства в следующем порядке: холинолитики – агонисты дофаминовых рецепторов – амантадины – ингибиторы ингибиторы катехол-о-метилтрансферазы – ингибиторы моноаминоксидазы.
2.2. В случае, если отмена вышеперечисленных препаратов не привела к должному эффекту, возможно снижение дозы препаратов леводопы. Отмена терапии препаратами леводопы недопустима.
3. Коррекция терапии другими (непротивопаркинсоническими) препаратами, обладающими психотропным и холинолитическим эффектом – трициклических антидепрессантов, транквилизаторов, оксибутинина и детрузитола и пр.
4. Назначение антипсихотиков:
4.1. Препараты первой очереди – клозапин 6,25 мг ежедневно перед сном, при необходимости увеличение в течение 4-7 дней до 50 мг; кветиапин 12,5-25 мг ежедневно перед сном, при необходимости увеличение дозы до 50 мг два раза в день.
4.2. Не рекомендовано использование оланзапина, рисперидона, зипрасидона, арипипразола.
5. Назначение ингибиторов ацетилхолинестеразы (ривастигмин, галантамин, донепезил). При нарушении глотания возможно использование ривастигмина в форме трансдермальной терапевтической системы.
Злокачественный нейролептический синдром (ЗНС) – это ятрогенная, потенциально фатальная патология, которая может развиться на фоне приема любых препаратов, блокирующих дофаминергическую передачу. Чаще всего данный синдром развивается в ответ на прием типичных нейролептиков, однако описаны случаи развития ЗНС и при терапии атипичными нейролептиками. Клиническая картина ЗНС представлена в табл. 4.
Таблица 4. Критерии злокачественного нейролептического синдрома
| Симптомы | Levenson J.L., 1985 | DSM-IV, 1994 |
| Главные |
- лихорадка - мышечная ригидность - повышение креатинкиназы |
- тяжелая мышечная ригидность - лихорадка |
| Сопутствующие |
- тахикардия - лабильность артериального давления - тахипноэ - нарушение сознания - повышенное потоотделение - лейкоцитоз |
- повышенное потоотделение - дисфагия - тремор - недержание мочи - нарушение сознания/мутизм - тахикардия - лабильность артериального давления - лейкоцитоз - повышение креатинкиназы |
Диагноз ЗНС подтверждается при наличии 3 главных симптомов или 2 главных и 4 сопутствующих симптомов.
Для ЗНС характерны изменения лабораторных показателей:
- повышение креатинкиназы (>90%);
- полиморфонуклеарный лейкоцитоз (75%);
- снижение уровня железа (95%);
- протеинурия;
- снижение уровня калия, магния;
- повышение уровня щелочной фосфатазы, АЛТ, АСТ.
Основа терапии ЗНС – отмена нейролептика и проведение всех мероприятий, проводимых при АГС.
5. Деменция и COVID-19
Сегодня деменция рассматривается как пандемия среди лиц пожилого возраста, а так как пожилые пациенты входят в группу риска при выявлении COVID-19, актуальность проблемы значительно возрастает. По данным Всемирной организации здравоохранения (ВОЗ) в 2017 г. в мире насчитывалось более 50 млн официально зарегистрированных пациентов с деменцией (Alzheimer’s Disease International. World Alzheimer’s report, 2019). Распространенность деменции среди лиц старше 65 лет в развитых странах оценивается от 5 до 10%, при этом на долю сосудистой деменции (СД) приходится не менее 20% всех случаев (Wu, Y.T. et al., 2016).
5.1. Влияние деменции на риск заболеваемости и диагностику COVID-19.
Пациенты с нарушением когнитивных функций имеют повышенный риск заразиться COVID-19, так как часто не могут получить и понять необходимую информацию об актуальности проблемы, методах профилактики заболеваемости, не могут самостоятельно осуществить эти методы, не осознают необходимости строгого соблюдения режима самоизоляции. Ограниченность доступа пациентов с когнитивными нарушениями к актуальной информации (особенно при самостоятельном проживании) может привести к тому, что ранние симптомы заболевания не будут распознаны, что приведет к риску прогрессирования инфекции и развитию осложнений. Дополнительными факторами, которые могут повышать риск осложненного течения COVID-19 являются малоподвижный образ жизни пациентов, часто недостаточное питание, обезвоживание, наличие сопутствующей соматической патологии, что особенно характерно для пациентов с сосудистой деменцией. В клинической картине некоторых нейродегенеративных заболеваний, сопровождающихся развитием когнитивных нарушений, может наблюдаться бульбарная и псевдобульбарная симптоматика, слабость мышц, что значимо влияет на риск развития дыхательной недостаточности (деменция лобного типа).
5.2. Влияние COVID-19 на клиническую картину деменции.
Декомпенсация любого соматического или наличие инфекционного заболевания оказывает существенное влияние на состояние когнитивных функций у пожилых пациентов вследствие большого числа патогенетических факторов. Даже при легких и среднетяжелых формах может оказывать влияние токсический фактор, обезвоживание. При развитии осложненного течения заболевания, развитие дыхательной недостаточности, нарушений гемодинамики, полиорганных нарушений вызывают гипоперфузию и гипоксию мозговой ткани. Клиническими проявлениями могут быть общая слабость, апатия, потеря аппетита, интереса к окружающему, астения, прогрессирование когнитивных нарушений, дезориентировки, появление спутанности, галлюцинаций, бреда. Риск декомпенсации когнитивных нарушений повышается у пациентов с более выраженными расстройствами. Указанная симптоматика, особенно быстро развившаяся, требует проведения дифференциального диагноза с острым нарушением мозгового кровообращения.
5.3. Особенности медикаментозной терапии деменции при наличии COVID-19.
В настоящее время отсутствуют рекомендации по ведению пациентов с деменцией в условиях COVID-19, в связи с чем целесообразно тактику лечения определять индивидуально, используя принятые схемы терапии когнитивных нарушений. Основными препаратами, используемыми в лечении деменции, являются ингибиторы ацетилхолинэстеразы (донепезил, ривастигмин, галантамин) и мемантин.
При легком и среднетяжелом течении COVID-19, когда лечение пациента осуществляется в домашних условиях, терапия базисными антидементными препаратами остается прежней. Для снижения риска ухудшения когнитивных функций пациентам рекомендуется сбалансированное питание. Для профилактики дегидратации – употребление 2,5-3 л жидкости в сутки, за исключением пациентов, которым требуется ограничение потребления жидкости (сердечная недостаточность) и водный режим определяется индивидуально кардиологом.
При среднетяжелом течении (стационарное лечение) в отсутствие дыхательной и/или сердечной недостаточности и нарушений гемодинамики, терапия когнитивных нарушений может проводиться в прежнем объеме, при нестабильной гемодинамике (брадикардия, нарушения AV-проводимости, синдром слабости синусового узла) следует осуществлять постоянный мониторинг электрокардиографии, рассмотреть вопрос о целесообразности снижения дозировки ингибиторов ацетилхолинэстеразы или замене на мемантин.
Вопрос о целесообразности продолжении базисной антидементной терапии у пациентов, находящихся на ИВЛ, должен решаться индивидуально, после стабилизации состояния в случае отмены, терапия должна быть возобновлена в кратчайшие сроки.
При появлении спутанности, бреда, галлюцинаций показана консультация психиатра.
5.4. Особенности специфической терапии COVID-19 у пациентов с деменцией.
В настоящее время отсутствуют данные о возможном взаимодействии препаратов специфической терапии COVID-19 и базисных антидементных препаратов. При применении хлорохина, комбинации лопинавир + ритонавир у пожилых людей следует соблюдать осторожность, учитывая повышенный риск декомпенсации сопутствующих заболеваний.
6. Легкая черепно-мозговая травма и COVID-19
6.1. На настоящий момент отсутствует информация о том, что клиническая картина и особенности течения легкой черепно-мозговой травмы (лЧМТ) – сотрясения головного мозга и ушиб головного мозга легкой степени тяжести – у пациентов с COVID-19 отличаются от таковых в общей популяции.
6.2. Можно предполагать более тяжелое течение ЧМТ у пациентов с симптомами поражения ствола головного мозга; с ограничением объема движений (ввиду тяжести состояния или вследствие неврологического дефицита); проходящих лечение в отделении ОРИТ ввиду тяжести состояния; входящих в группу риска по сопутствующей патологии других органов и систем; тяжелым течением COVID-19.
6.3. Ввиду того, что особенности течения COVID-19 подразумевают повышение риска падения и получения ЧМТ, вероятностью нарушения адекватной самооценки пациентом с ЧМТ, при поступлении пациента с ЧМТ целесообразно одновременно с рентгенологическим исследованием головы (КТ головы) проводить исследование легких (рентгенография, КТ), рекомендуемый объем лабораторных и инструментальных исследований для исключения пневмонии.
6.4. Лечение сотрясения головного мозга и ушиба головного мозга легкой степени тяжести у пациентов с COVID-19 проводится в соответствии со стандартными рекомендациями. Дополнительно целесообразно рекомендовать регулярную вертикализацию и ограничение приема НПВП, применяемых с целью обезболивания.
6.5. Реабилитация и восстановительное лечение пациентов с последствиями ЧМТ средней и тяжелой степени тяжести в настоящее время крайне ограничено в стационарных условиях. Необходимость обеспечения непрерывности лечебного процесса и контроль за его эффективностью в домашних условиях определяет необходимость активного сопровождения медицинским персоналом по месту жительства.
7. Травма спинного мозга и COVID-19
7.1. На настоящий момент отсутствует информация о том, что клиническая картина и особенности течения травмы спинного мозга у пациентов с COVID-19 отличаются от таковых в общей популяции, однако можно предполагать взаимное отягощение данных заболеваний, обусловленное особенностями неврологического дефицита.
7.2. Ввиду повышенного риска развития воспалительных заболеваний легких вследствие гиподинамии у пациентов с травмами спинного мозга необходимо активно проводить мероприятия по их профилактике, в том числе:
- осуществлять забор материала для исследования на COVID-19 при поступлении;
- при выполнении рентгенологических исследований выполнять дополнительно КТ органов грудной клетки для исключения COVID-19 или пневмонии;
- регулярно контролировать температуру тела, оксигенацию крови и наличие признаков острого респираторного заболевания;
- особое внимание обратить на выполнение мероприятий по уходу за пациентом с заболеваниями и травмами спинного мозга.
7.3. Тактику лечения и проведения реабилитационных мероприятий (в соответствии со сроками заболевания) целесообразно определять индивидуально.
8. Демиелинизирующие заболевания центральной нервной системы и COVID-19
В настоящее время нет однозначного мнения относительно риска развития COVID-19 у пациентов с рассеянным склерозом (РС) и заболевания спектра оптиконейромиелита (ЗСОНМ) не получено. Однако пациенты с РС и другими демиелинизирующими заболеваниями ЦНС имеют более высокий риск развития любой инфекции, включая пневмонии. Особое внимание обращают на пациентов с выраженной инвалидизацией, бульбарным синдромом, у которых риск развития инфекционных осложнений более высокий. Пациенты с РС и ЗСОНМ чаще на фоне инфекций переводятся или поступают в ОРИТ. Пациенты, получающие моноклональные препараты, изменяющие течение рассеянного склероза (ПИТРС), подвержены повышенному риску инфекций. При лечении обострения РС пульс-терапией метилпреднизолона учитывать более высокий риск реактивации латентной инфекции.
При лечении пациентов с COVID-19 и демиелинизирующим заболеванием центральной нервной системы необходимо учитывать следующие особенности:
8.1. В настоящее время нет никаких данных о том, как коронавирус COVID-19 влияет на пациентов с РС.
8.2. Пациенты с РС должны уделять особое внимание актуальным рекомендациям по снижению риска заражения COVID-19, разработанных Росздравнадзором и Министерством здравоохранения РФ, включая дополнительные рекомендации для людей, подверженных риску серьезных осложнений COVID-19.
8.3. Члены семьи, которые проживают совместно с пациентом с РС, или люди, осуществляющие за ним уход на периодической основе, также должны следовать этим рекомендациям, чтобы уменьшить вероятность занесения инфекции COVID-19 в дом.
8.4. В настоящее время нет никаких конкретных рекомендаций в отношении COVID-19 для беременных пациенток с РС.
8.5. Нет никаких конкретных рекомендаций для детей с РС, они должны следовать приведенным выше советам для взрослых пациентов с РС.
8.6. Пациенты с РС, начинающие терапию ПИТРС, должны обсудить все риски начала терапии со своим лечащим врачом.
8.7. Пациенты с РС, получающие терапию ПИТРС, должны обсудить риски прекращения терапии со своим лечащим врачом до принятия решения о ее прекращении.
8.8. Пациенты с РС, которым планируется смена терапии ПИТРС в связи с неэффективностью, должны быть предупреждены обо всех рисках новой терапии, рисках активности заболевания и возможных сроках начала новой терапии ПИТРС (в случае ПИТРС 2-ой линии).
8.9. В случае обострения рассеянного склероза возможно проведение стероидной пульс-терапии метилпреднизолоном в стандартном режиме только у пациентов с отсутствием короновирусной инфекции COVID-19. Пациент должен быть информирован о соблюдении дополнительных рекомендаций для людей, подверженных риску серьезных осложнений от коронавирусной инфекции COVID-19.
8.10. Для купирования болевых синдромов, побочных действий при использовании ПИТРС и других идентичных состояниях отказаться от назначения ибупрофена. Препаратом выбора является парацетамол в стандартных дозировках.
8.11. Выписку рецептов целесообразно проводить на 180 дней в электронном виде при возможности с доставкой лекарственных средств пациентам на дом.
8.12. Выбор терапии ПИТРС является сложным процессом, учитывающим множество факторов, одним из которых в течение нескольких последних месяцев является COVID-19. Пациентам с впервые установленным диагнозом РС или ранее не получавшим ПИТРС, и планирующим начало терапии в период пандемии COVID-19, в качестве препарата первого выбора следует рассматривать тот, который не обладает иммуносупрессивным эффектом.
8.13. Терифлуномид и диметилфумарат могут вызывать лейкопению и/или лимфопению, поэтому необходимо тщательно рассмотреть риски и преимущества начала терапии этими препаратами во время эпидемии COVID-19.
8.14. Терапия окрелизумабом, алемтузумабом или кладрибином связана с повышенным риском вирусных инфекций. Несмотря на то, что по мнению некоторых зарубежных коллег риск вирусных инфекций можно предсказать по общему количеству лимфоцитов, данных литературы в поддержку подобного мнения недостаточно. Поэтому в зависимости от клинической ситуации начало терапии или проведение повторных лечебных циклов окрелизумабом, алемтузумабом или кладрибином следует отложить до стабилизации эпидемиологической обстановки.
8.15. На сегодня нет данных, что натализумаб обладает имуносупрессивным эффектом, поэтому для пациентов с высокоактивным РС или быстропрогрессирующим РС натализумаб рекомендован в первую очередь в качестве препарата выбора.
8.16. Учитывая отсутствие знаний или данных о течении COVID-19 у пациентов с РС, получающих ПИТРС, в настоящее время прекращение терапии не рекомендовано. Возобновление активности заболевания в случае прекращения терапии сопряжено с большим риском для здоровья, чем продолжение терапии ПИТРС.
8.17. В целях обеспечения безопасности пациентов и минимизации риска заражения COVID-19 все плановые консультации по демиелинизирующим заболеваниям должны быть проведены, при наличии соответствующих возможностей, с использованием телемедицинских технологий. При отсутствии таковых частоту консультаций следует сократить.
9. Миастения и синдром Ламберта-Итона при COVID-19
Клиническая картина миастении и синдрома Ламберта-Итона при COVID-19 не отличается от таковой в общей популяции. Однако наличие миастении у пациента c COVID-19 увеличивает мышечную слабость и одышку. Неконтролируемая (плохо контролируемая) миастения может увеличить риск развития миастеничекого криза и привести к значительному прогрессированию дыхательной недостаточности, особенно на фоне короновирусной пневмонии.
9.1. Признаки, определяющие высокий или очень высокий риск тяжелого течения COVID-19:
- слабость дыхательной мускулатуры, выражающаяся в ЖЕЛ менее 60%, особенно у пациентов с кифосколиозом;
- использование дыхательной маски или наличие трахеостомы;
- слабый кашлевой толчок;
- нарушение работы сердца (и/или получение терапии по поводу кардиальной патологии);
- риск ухудшения состояния при появлении лихорадки, инфекции или при голодании;
- риск рабдомиолиза;
- сопутствующие сахарный диабет и ожирение;
- пациенты, принимающие стероиды и другие иммунодепрессанты.
В настоящее время нет данных о том, как COVID-19 влияет на людей с миастенией и синдромом Ламберта-Итона или пациентов с другими заболеваниями при иммуносупрессивной терапии. Однако поскольку большинство пациентов с миастенией и синдромом Ламберта-Итона получают иммуносупрессивную или иммуномодулирующую терапию и могут также иметь слабость дыхательных мышц, существует теоретическая проблема, что пациенты с миастенией и синдромом Ламберта-Итона могут подвергаться более высокому риску заражения инфекцией или иметь более тяжелые проявления COVID-19. Также отсутствует рецензируемая опубликованная литература, касающаяся COVID-19 при миастении.
Предлагается, чтобы терапевтические решения были индивидуализированы и принимались совместно человеком с миастенией и его врачом, основанными в первую очередь на национальных и дополнительных рекомендациях.
Пациенты с миастенией и синдромом Ламберта-Итона должны следовать соответствующим национальным рекомендациям и любым дополнительным рекомендациям для людей с риском серьезных заболеваний от COVID-19.
9.2. Особенности ведения пациентов, получающих лечение по поводу миастении и синдрома Ламберта-Итона:
9.2.1. Пациентам с миастенией и синдромом Ламберта-Итона следует продолжить текущее лечение, и им рекомендуется не прекращать какие-либо существующие лекарства, если это специально не обсуждено и не одобрено их лечащим врачом.
9.2.2. Нет научных данных, позволяющих предположить, что симптоматическая терапия, такая как пиридостигмин или 3,4-диаминопиридин, увеличивает риск инфекции и не должна прекращаться, если нет других клинических причин для этого.
9.2.3. Несмотря на отсутствие убедительных доказательств, рекомендуется, чтобы пациенты с миастенией, уже принимающие иммуносупрессивные препараты, должны придерживаться увеличенного социального дистанцирования и, если возможно, избегать общения лицом к лицу, отдавая предпочтение индивидуальным дистанционным консультациям (например, телемедицина), если это возможно.
9.2.4. При изменении или прекращении существующей иммуносупрессивной терапии, которая несет в себе риск усиления активности заболевания и/или обострения или возникновения миастенического криза, люди с миастенией и их лечащие врачи должны учитывать конкретные риски (например, возраст, сопутствующие состояния здоровья, местоположение) и выгоды.
9.3. Инфузионная терапия, внутривенные иммуноглобулины и обмен плазмы
9.3.1. Проведение инфузионной терапии при миастении могут потребовать поездки в больницу или инфузионные центры, при этом настоятельно рекомендуется принять это решение на основе региональной заболеваемости COVID-19 и риска/пользы терапии для каждого конкретного пациента. При возможности необходимо рассмотреть возможность перехода на проведение инфузионной терапии на дому.
9.3.2. В настоящее время нет доказательств того, что внутривенный иммуноглобулин или терапевтический обмен плазмы несут какой-либо дополнительный риск заражения COVID-19. Тем не менее, использование внутривенного иммуноглобулина должно основываться на индивидуальных потребностях пациента, и следует избегать недискриминационного использования. В целом, внутривенный иммуноглобулин или терапевтический обмен плазмы должны быть зарезервированы для пациентов с обострениями заболевания. Категория пациентов, получающие их в качестве поддерживающей терапии, должны соблюдать дополнительные меры предосторожности при поездках в медицинское учреждение и обратно.
9.3.3. В настоящее время нет данных, подтверждающих, что целенаправленное ингибирование C5-комплемента с использованием экулизумаба увеличивает восприимчивость к COVID-19 или ее исходу.
9.4. Некоторые из методов лечения миастении требуют частого мониторинга работы крови, и решения относительно постоянной потребности в тестировании, требующей ухода пациента из дома, должны быть индивидуализированы и основаны на региональной заболеваемости COVID-19.
9.5. Перед началом анти-В-клеточной терапии (например, ритуксимаба), следует учитывать риск усугубления миастении или возникновения миастенического криза и риск заражения вирусной инфекцией. В части случаев целесообразно отложить начало анти-В-клеточной терапии до разрешения эпидемиологической обстановки. Тем не менее, риск не начинать терапию у отдельных пациентов может перевесить риск тяжелой инфекции COVID-19, в этом случае следует предпринимать действия, основанные на индивидуальном анализе рисков каждого конкретного пациента.
9.6. У большинства пациентов, у которых развивается COVID-19, имеется легкое заболевание, и они должны продолжать применять современные стандарты медицинской помощи для миастении и синдрома Ламберта-Итона. Может возникнуть необходимость в увеличении дозы глюкокортикостероидов. Тем не менее, если симптомы являются серьезными (требующими госпитализации), может потребоваться временно приостановить текущую иммуносупрессию, особенно при наличии сопутствующих инфекций/сепсиса.
10. Заболевания, травмы периферической нервной системы и COVID-19
В большинстве случаев заболевания и травмы периферической нервной системы не являются дополнительным фактором, отягчающим течение COVID-19, за исключением нижеперечисленных состояний.
10.1. Острая воспалительная демиелинизирующая полиневропатия (синдром Гийена-Барре).
У пациентов с COVID-19 развитие синдрома Гийена-Барре может представлять дополнительный умеренный риск возникновения осложнения течения инфекционного процесса только в случае сопутствующей слабости дыхательной мускулатуры (восходящего паралича Ландри). К настоящему времени отсутствуют данные о связи между COVID-19 и риском возникновения синдрома Гийена-Барре. Какой-либо коррекции лечения острой воспалительной демиелинизирующей полиневропатии у пациентов с COVID-19 не требуется.
10.2. Хроническая воспалительная демиелинизирующая полиневропатия.
У пациентов с COVID-19 наличие хронической воспалительной демиелинизирующей полиневропатии может представлять дополнительный риск осложнения течения инфекционного процесса только в случае сопутствующей слабости дыхательной мускулатуры или использования иммуносупрессивной терапии. Необходимо отметить, что пациенты, принимающие глюкокортикостероиды, не должны прерывать терапию. В то же самое время, суточная доза преднизолона более 10 мг должна расцениваться как дополнительный фактор риска осложнения течения COVID-19, а именно: глюкокортикостероиды в дозе 10-19 мг/сут без сопутствующей иммуносупрессивной терапии – умеренный риск, глюкокортикостероиды в дозе 10-19 мг/сут при наличии сопутствующей иммуносупрессивной терапии – высокий риск, глюкокортикостероиды в дозе 20 мг/сут и более – высокий риск. Следует помнить о риске развития надпочечниковой недостаточности на фоне COVID-19 у пациентов, недавно закончивших прием глюкокортикостероидов или находящихся на поддерживающих (небольших) дозах препаратов после пульс-терапии. Также необходимо отметить, что лопиновир/ритонавир могут усиливать эффект глюкокортикостероидов.
10.3. Заболевания и травмы нервной системы с необходимостью противоболевой терапии.
В настоящее время наиболее распространёнными препаратами для лечения боли являются НПВП. В соответствии с существующими национальными руководствами пациенты и медицинские работники могут продолжать использовать НПВП, в том числе ибупрофен, согласно инструкции по применению. Текущая позиция предполагает использование этих препаратов в минимально эффективной дозе в течение возможно кратчайшего период времени. Пациентам с сердечной недостаточностью или артериальной гипертензией при болевом синдроме предпочтительнее назначать ацетаминофен нежели другие НПВП во избежание декомпенсации сердечно-сосудистых заболеваний. Необходимо помнить, что применение НВПП за счет угнетающего воздействия последних на воспаление и гипертермию может скрыть ряд клинических симптомов текущей COVID-19, что приведет к задержке в постановке диагноза.
При использовании антиконвульсантов (габапентин, прегабалин и пр.) для лечения пациентов с нейропатической болью следует учитывать возможное негативное взаимодействие с препаратами, рекомендованными в качестве терапии COVID-19
(см. табл. 2.).
11. Заболевания вегетативной нервной системы и COVID-19.
11.1. Наличие заболеваний вегетативной нервной системы подвергает пациента большему риску заражения инфекциями или их более тяжелому течению, поскольку эти пациенты предрасположены к развитию более тяжелых сердечно-сосудистых, дыхательных и желудочно-кишечных осложнений, включая нарушения глотания.
11.2. Применение у некоторых пациентов для лечения иммуномодулирующих средств для лечения иммуноопосредованных форм вегетативной недостаточности может ухудшать как течение основного заболевания, так и COVID-19. В настоящее время отсутствуют рекомендации по коррекции такой терапии в условиях COVID-19.
11.3. В настоящее время нет убедительных данных о каком-либо повышенном или сниженном риске при приеме препаратов, применяемых при лечении заболеваний сердечно-сосудистой системы (в частности ингибиторы АПФ, бета-блокаторы и другие), в связи с чем изменение схемы лечения не требуется.
11.4. Для пациентов с COVID-19 и заболеваниями вегетативной нервной системы, использующих НПВП (например, ибупрофен) или глюкокортикостероиды, дальнейшее применение этих препаратов должно быть взвешено и оценено индивидуально.
11.5. У пациентов с заболеваниями вегетативной нервной системы и COVID-19 интенсивный кашель может вызвать рефлекторный обморок, а обезвоживание и потеря жидкости могут усугубить ортостатическую гипотензию, увеличивая риск обморока и падений.
11.6. Можно предполагать развитие у пациентов, выздоравливающих после COVID-19, таких состояний, как ортостатическая гипотензия, синдром постуральной тахикардии.
Таблица 5. Особенности применения препаратов для лечения COVID-19 у пациентов неврологического профиля
| Препарат | Противопоказание к применению со стороны заболеваний нервной системы | Побочные эффекты на нервную систему | Взаимодействие с препаратами для лечения заболеваний нервной системы |
| Тоцилизумаб (Актемра) | – | Часто: головная боль, головокружение |
Концентрация симвастатина (субстрат СYP3A4) через 1 нед после однократного введения тоцилизумаба снижалась на 57% до аналогичной или немного повышенной концентрации симвастатина у здоровых добровольцев. В начале или при завершении курса терапии Актемрой следует тщательно наблюдать за пациентами, получающими лекарственные средства, которые метаболизируются посредством изоферментов CYP450 3A4, 1A2 или 2C9 (например аторвастатин, ловастатин, БКК, теофиллин, варфарин, фенитоин, циклоспорин или бензодиазепины). Для обеспечения терапевтического действия этих препаратов, возможно, потребуется увеличение их дозы. Учитывая длительный T1/2 Актемры, ее действие на активность изоферментов CYP450 может сохраняться в течение нескольких недель после прекращения терапии. В начале терапии тоцилизумабом уменьшается экспозиция симвастатина у пациентов с ревматоидным артритом. В начале терапии тоцилизумабом уменьшается экспозиция омепразола у пациентов с ревматоидным артритом. Фармакокинетические параметры тоцилизумаба остаются неизменными при одновременном применении с трамадолом. В начале или при завершении курса терапии тоцилизумабом следует тщательно наблюдать за пациентами, получающими фенитоин (метаболизируется посредством изоферментов CYP450). Для обеспечения терапевтического действия фенитоина, возможно, потребуется увеличение его дозы. Учитывая длительный T1/2 тоцилизумаба, его действие на активность изоферментов CYP450 может сохраняться в течение нескольких недель после прекращения терапии. Фармакокинетические параметры тоцилизумаба остаются неизменными при одновременном применении с фолиевой кислотой и ее производными. Фармакокинетические параметры тоцилизумаба остаются неизменными при одновременном применении с целекоксибом. |
| Лопинавир + Ритонавир (Калетра) | – | Часто: головная боль, мигрень, бессонница, нейропатия, периферическая нейропатия, головокружение, тревожность; нечасто: агевзия, судороги, тремор, цереброваскулярные нарушения, нарушение сна, снижение либидо. Нечасто: вестибулярное головокружение, шум в ушах. |
Применение препарата Калетра один раз в день в комбинации с карбамазепином, фенобарбиталом или фенитоином противопоказано. Кроме того, одновременное применение фенитоина и лопинавира/ритонавира приводит к умеренному уменьшению равновесных концентраций фенитоина. Концентрации фенитоина следует контролировать при применении препарата одновременно с лопинавиром/ритонавиром. Возможно влияние на концентрации варфарина при одновременном применении с лопинавиром/ритонавиром. Рекомендуется контролировать МНО. Одновременное применение ривароксабана с лопинавиром/ритонавиром может вызвать повышение концентрации ривароксабана, что может привести к повышению риска возникновения кровотечений. Одновременное применение бупропиона с лопинавиром/ритонавиром уменьшает плазменные концентрации бупропиона и его активного метаболита (гидроксибупропиона). Если одновременное применение лопинавира/ритонавира с бупропионом необходимо, то его следует проводить под тщательным клиническим контролем за эффективностью бупропиона без превышения рекомендованной дозы, несмотря на наблюдаемое усиление метаболизма. Одновременное применение ритонавира и тразодона может привести к увеличению концентрации тразодона. Наблюдались побочные эффекты: тошнота, головокружение, артериальная гипотензия и обморок. Применять тразодон с ингибитором изофермента CYP3A4, таким как лопинавир/ритонавир, следует с осторожностью и снизив дозу тразодона. Ламотриджин и вальпроевая кислота: При одновременном применении данных препаратов с лопинавиром/ритонавиром наблюдалось снижение концентраций ламотриджина и вальпроевой кислоты. Снижение концентрации ламотриджина достигало 50%. Данные комбинации лекарственных препаратов должны использоваться с осторожностью. При одновременном применении данных препаратов с лопинавиром/ритонавиром, особенно в период подбора дозы, может потребоваться повышение дозы ламотриджина или вальпроевой кислоты, а также контроль их концентрации в плазме крови. При одновременном применении лидокаина с комбинацией лопинавир + ритонавир может увеличиться концентрация лидокаина. Необходима осторожность при его применении и контроль терапевтической концентрации, если возможно. Так как комбинация лопинавир + ритонавир является ингибитором изоферментов CYP3A, концентрация кветиапина, клиренс которого значительно зависит от метаболизма посредством изоферментов СYР3А, в плазме крови может увеличиваться. Одновременное применение комбинации лопинавир + ритонавир с кветиапином противопоказано. Лопинавир/ритонавир может вызвать значительное повышение плазменных концентраций ингибиторов ГМГ-КоА редуктазы, метаболизирующихся под действием CYP3A4, таких как ловастатин и симвастатин. Увеличение концентраций этих статинов может привести к развитию миопатии, в том числе рабдомиолиза, поэтому их сочетание с лопинавиром/ритонавиром противопоказано. Розувастатин и аторвастатин, метаболизм которых менее зависим от фермента CYP3A4, вместе с ритонавиром/лопинавиром следует применять с осторожностью в минимальных дозах. При приеме в сочетании с лопинавиром/ритонавиром наблюдалось увеличение Cmax и AUC аторвастатина в 4,7 и 5,9 раза соответственно, что увеличивает риск серьезных побочных реакций миопатии и рабдомиолиза. Признаков клинически значимого взаимодействия лопинавира/ритонавира с правастатином не выявлено. Метаболизм правастатина и флувастатина не зависит от CYP3A4, поэтому они не должны взаимодействовать с лопинавиром/ритонавиром. Если показано лечение ингибиторами ГМГ-КоА редуктазы в период применения лопинавира/ритонавира, то рекомендуется использовать правастатин или флувастатин. Влияние на способность к вождению автотранспорта, управлению механизмами: В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При развитии побочных эффектов, которые могут влиять на указанные способности, например, головокружения, рекомендуется воздержаться от вождения автотранспорта и управления механизмами. Исследования способности к вождению автотранспорта и управления механизмами не проводились. |
| Интерферон альфа-2b (Интрон А) | Эпилепсия и другие нарушения функции ЦНС, психические заболевания и расстройства у детей и подростков. |
Головная боль 51-64%, депрессия 16-36%, раздражительность 13-27%, бессонница 21-28%, беспокойство 8-12%, нарушение способности к концентрации внимания 8-14%, эмоциональная лабильность 8-14%, редко – суицидальные наклонности; очень редко — агрессивное поведение, в т.ч. направленное на других людей, суицидальные попытки, суицид, психоз (в т.ч. галлюцинации), нарушение сознания, нейропатия, полинейропатия, энцефалопатия, цереброваскулярная ишемия, цереброваскулярная геморрагия, периферическая невропатия, судороги. |
С осторожностью следует применять Интрон® А одновременно с опиоидными анальгетиками, снотворными и седативными средствами. Интерферон альфа-2b может усиливать нейротоксическое действие ЛС, назначавшихся ранее или одновременно с ним. Следует избегать сочетанного назначения интерферона альфа-2b с ЛС, угнетающими ЦНС. Интерферон альфа-2b способен снижать активность цитохрома Р450 и изменять метаболизм варфарина. Интерферон альфа-2b способен снижать активность цитохрома Р450 и изменять метаболизм диазепама. Интерферон альфа-2b способен снижать активность цитохрома Р450 и изменять метаболизм дипиридамола. Интерферон альфа-2b способен снижать активность цитохрома Р450 и изменять метаболизм фенитоина. Влияние на способность к управлению транспортными средствами и механизмами. Пациента необходимо предупредить о возможности развития слабости, сонливости, нарушений сознания на фоне терапии и рекомендовать избегать управления транспортными средствами и механизмами. |
| Интерферон бета-1b (Бетаферон) |
Эпилепсия (адекватно не контролируемая). С осторожностью: пациентам, в анамнезе которых имеется указание на депрессию или судороги, а также пациентам, получающим противосудорожные средства. |
тревожные состояния. гипертонус, головокружение, бессонница, нарушение координации, беспокойство, нервозность. нечасто – мышечный гипертонус, депрессия; редко – судороги, спутанность сознания, возбуждение, эмоциональная лабильность, суицидальные попытки, анорексия. |
Необходимо соблюдать осторожность при назначении интерферона бета-1b в комбинации с противоэпилептическими ЛС, имеющими узкий терапевтический индекс, клиренс которых в значительной степени зависит от активности CYP450, т.к. интерферон бета-1b снижает активность изоферментов цитохрома P450. |
| Мефлохин (Лариам) | Эпилептические и другие судорожные припадки, острые психозы. |
Профилактические дозы: головная боль, головокружение, обморок, обратимые нейропсихические нарушения (судороги, депрессия, психозы) Терапевтические дозы: быстрая утомляемость, нейропсихические нарушения (головокружение, головная боль, расстройство зрения, шум в ушах, бессонница, беспокойство, тревожность, возбуждение, депрессия, дезориентация, снижение памяти, спутанность сознания, галлюцинации, острые психозы или припадки). |
Снижает противоэпилептическую активность вальпроевой кислоты, натрия дивальпроата. При одновременном применении мефлохин снижает эффективность (в т.ч. контроля судорог) противосудорожных ЛС, уменьшая их концентрацию в плазме крови. Мефлохин, как правило, противопоказан пациентам с судорогами в анамнезе. Необходимо контролировать концентрацию противосудорожных ЛС в крови — может потребоваться коррекция их дозы. Одновременное применение мефлохина и трициклических антидепрессантов, влияющих на сердечную проводимость, может привести к удлинению интервала QT. Циталопрам может снижать порог судорожной готовности, поэтому рекомендуется соблюдать осторожность при одновременном применении его и мефлохина, снижающего порог судорожной готовности. Необходимо соблюдать осторожность при одновременном применении эсциталопрама (может снижать порог судорожной готовности) и мефлохина, снижающего порог судорожной готовности. При сочетанном применении метопролола (в составе комбинации винпоцетин + индапамид + метопролол + эналаприл) с мефлохином увеличивается риск брадикардии. Вортиоксетин может снижать порог судорожной готовности. Одновременное применение с мефлохином, снижающим порог судорожной готовности, должно осуществляться с осторожностью. Противопоказано одновременное применение галоперидола с мефлохином, удлиняющим интервал QT, т.к. повышается риск развития желудочковой аритмии, включая аритмию типа «пируэт». Мефлохин в сочетании с дексаметазоном может повышать риск развития миопатии, в т.ч. кардиомиопатии. При одновременном применении клозапина и мефлохина повышается риск развития удлинения интервала QT; необходимо соблюдать осторожность. При одновременном применении мефлохин снижает эффективность (в т.ч. контроля судорог) фенитоина, уменьшая его концентрацию в плазме крови. Мефлохин, как правило, противопоказан пациентам с судорогами в анамнезе. Необходимо контролировать концентрацию фенитоина в крови – может потребоваться коррекция его дозы. При одновременном применении мефлохин снижает эффективность (в т.ч. контроля судорог) фенобарбитала, уменьшая его концентрацию в плазме крови. Мефлохин, как правило, противопоказан пациентам с судорогами в анамнезе. Необходимо контролировать концентрацию фенобарбитала в крови – может потребоваться коррекция его дозы. Следует с осторожностью применять флуоксетин в комбинации с мефлохином – риск удлинения интервала QT. |
| Хлорохин (Делагил) | Ограничен к применению: эпилепсия, миастения. | Головная боль, головокружение, расстройства сна, психоз, судорожные припадки; при длительном применении — помутнение роговицы, поражение сетчатки глаза, нарушение зрения, звон в ушах. |
В комбинации с глюкокортикоидами увеличивает риск развития миопатии и кардиомиопатии, с ингибиторами МАО – токсичность. Эффект ботулинического токсина типа А – миорелаксанта периферического действия – может быть снижен при одновременном применении хлорохина. При одновременном применении вальпроевой кислоты и хлорохина существует риск провоцирования судорожных припадков. Хлорохин снижает противосудорожный эффект карбамазепина. При одновременном назначении хлорохин может усиливать симптомы миастении и таким образом устранять эффект неостигмина метилсульфата. |
| Гидроксихлорохин (Плаквенил) | Ограничен к применению: заболевания ЦНС. |
Сенсорные нарушения, снижение сухожильных рефлексов, аномальная нервная проводимость, мышечная слабость, беспокойство, раздражительность, эмоциональная лабильность, психоз, головная боль, головокружение, судороги, шум в ушах, тугоухость, нарушение остроты зрения, нарушение аккомодации, отек и помутнение роговицы, скотома, фотофобия; при длительном применении в высоких дозах — ретинопатия (в т.ч. с нарушением пигментации и дефектами полей зрения), атрофия зрительного нерва, кератопатия, дисфункция цилиарной мышцы. Со стороны периферической нервной системы и мышц: отмечены случаи миопатии скелетных мышц или нейромиопатии, ведущие к прогрессирующей слабости и атрофии проксимальных мышечных групп. Миопатия может быть обратимой после отмены препарата, но для полного восстановления может потребоваться несколько месяцев. Одновременно могут наблюдаться слабые сенсорные изменения, подавление сухожильных рефлексов и снижение нервной проводимости. |
Усиливает побочные эффекты глюкокортикоидов, салицилатов, нейротоксичных средств. У гидроксихлорохина нельзя исключить взаимодействие с противоэпилептическими ЛС. При совместном применении с противоэпилептическими ЛС эффективность последних может быть недостаточной (было описано для хлорохина, но пока не наблюдалось при приеме гидроксихлорохина). Эффект ботулинического токсина типа А – миорелаксанта периферического действия — может быть снижен при одновременном применении гидроксихлорохина. Гепарин натрия Увеличивает вероятность кровотечения. Гидроксихлорохин в сочетании с дексаметазоном может повышать риск развития миопатии, в т.ч. кардиомиопатии. |
| Азитромицин (Сумамед) |
Противопоказан: фенилкетонурия С осторожностью: миастения. |
Головокружение, вертиго, головная боль, парестезия, возбуждение, повышенная утомляемость, сонливость; редко – шум в ушах, обратимое нарушение слуха вплоть до глухоты (при приеме в высоких дозах в течение длительного времени); у детей — головная боль (при терапии среднего отита), гиперкинезия, нервозность, тревожность, нарушение сна. часто – головная боль; нечасто – головокружение, нарушение вкусовых ощущений, парестезии, сонливость, бессонница, нервозность; редко – ажитация; неизвестная частота – гипестезия, тревога, агрессия, обморок, судороги, психомоторная гиперактивность, потеря обоняния, извращение обоняния, потеря вкусовых ощущений, миастения, бред, галлюцинации. |
При применении в терапевтических дозах азитромицин оказывает слабое влияние на фармакокинетику аторвастатина, карбамазепина При необходимости совместного приема с варфарином рекомендуется проводить тщательный контроль ПВ (возможно увеличение протромбинового времени и частоты развития геморрагий). В редких случаях сообщалось об усилении антикоагулянтного действия непрямых антикоагулянтов при одновременном применении с азитромицином. Фармацевтически несовместим с гепарином (нельзя смешивать в одном шприце). У пациентов, одновременно принимающих азитромицин и статины, существует риск развития рабдомиолиза. Одновременное применение галоперидола с азитромицином, удлиняющим интервал QT, противопоказано. Следует проявлять осторожность при одновременном применении домперидона – субстрата CYP3A4 и азитромицина – сильного ингибитора изофермента CYP3A4. При совместном применении азитромицина и карбамазепина возможно умеренное воздействие на фармакокинетику карбамазепина – при применении с другими макролидами сообщалось об увеличении концентрации карбамазепина. Корректировка дозы не рекомендуется, необходим тщательный контроль. Одновременное применение азитромицина (ингибитор изоферментов цитохрома P450) с клозапином в высоких дозах приводило к повышению концентрации клозапина в плазме крови и возникновению нежелательных реакций. При совместном применении азитромицина и метилпреднизолона возможно замедление экскреции, повышение концентрации метилпреднизолона в плазме крови и усиление риска проявления токсичности. При сочетанном применении ривароксабана и азитромицина возможно значительное увеличение экспозиции ривароксабана у пациентов с почечной недостаточностью. Одновременное применение у пациентов с почечной недостаточностью возможно только тогда, когда потенциальная польза оправдывает риск. Нет необходимости в специальных мерах предосторожности для пациентов с нормальной функцией почек. Необходимо соблюдать осторожность при совместном применении тизанидина с азитромицином, удлиняющим интервал QT. При одновременном применении азитромицина и фенитоина возможно увеличение концентрации фенитоина. Требуется тщательный мониторинг. Следует соблюдать осторожность при одновременном применении азитромицина с циталопрамом. |
| Надропарин кальция (Фраксипарин) |
Противопоказан: кровоизлияние в головной мозг (кроме системной эмболии), травмы ЦНС, состояние после спинномозговой пункции (следует соблюдать интервал минимум 12 ч между введением фраксипарина в профилактичеcких дозах или 24 ч в терапевтических дозах и введением или удалением спинального/эпидурального катетера или иглы. Для пациентов с почечной недостаточностью могут рассматриваться более длительные интервалы). Ограничен к применению: постуральная гипотензия, обмороки. |
– |
Усиливает эффект непрямых антикоагулянтов, антиагрегантов, НПВП. Никотиновая кислота изменяет эффект надропарина кальция. При сочетании НПВП с надропарином кальция усиливается гипокоагулянтный эффект, повышается риск развития кровотечения и гиперкалиемии. Совместное применение не рекомендуется. При необходимости совместного применения надропарина кальция с НПВП следует обеспечить тщательный клинический мониторинг. Усиливается гипокоагулянтный эффект и повышается риск развития кровотечения. Совместное применение не рекомендуется. Применение надропарина кальция не рекомендуется у пациентов, использующих салицилаты в дозах, применяемых для обезболивания, т.к. возможно увеличение риска развития кровотечения. Следует с осторожностью применять надропарин кальция у пациентов, получающих пероральные антикоагулянты, т.к. такое сочетание приводит к усилению антикоагулянтного эффекта. При замене надропарина кальция пероральным антикоагулянтом следует обеспечить усиленное клиническое наблюдение и продолжать применение надропарина кальция до стабилизации МНО. Противопоказано одновременное применение апиксабана и надропарина кальция в связи с высоким риском развития кровотечения за исключением ситуаций, когда пациент переводится на терапию или с терапии апиксабаном. Не рекомендуется применение надропарина кальция у пациентов, получающих ацетилсалициловую кислоту в дозах, применяемых для обезболивания, т.к. возможно повышение риска развития кровотечения (ацетилсалициловая кислота угнетает активность тромбоцитов и отрицательно воздействует на слизистую желудка и двенадцатиперстной кишки). При необходимости совместного применения надропарина кальция в терапевтических дозах с ацетилсалициловой кислотой требуется тщательное клиническое наблюдение и лабораторный мониторинг. При сочетании других гепаринов (низкомолекулярные или нефракционированные) с надропарином кальция повышается риск развития гиперкалиемии. Не рекомендуется применение надропарина кальция у пациентов, получающих клопидогрел, т.к. возможно повышение риска развития кровотечения. При необходимости совместного применения надропарина кальция в терапевтических дозах с клопидогрелом требуется тщательное клиническое наблюдение и лабораторный мониторинг. Никотиновая кислота может изменять эффект; совместное применение требует постоянного контроля показателей гемокоагуляции. |
Литература
1. Mao, L. Neurological Manifestations of Hospitalized Patients with COVID-19 in Wuhan, China: a retrospective case series study / L. Mao, M. Wang, S. Chen [et al.] // JAMA Neurol. – 2020. – e201127.
2. Курбанова, Ш.Б. Фебрильные судороги у детей: теоретические и практические аспекты (научный обзор) / Ш.Б. Курбанова, Г.К. Садыкова, Ш.А. Кудратов // Профилакт. и клин. медицина. – 2015. – No4. – С. 95-102.
3. Guidelines for epidemiologic studies on epilepsy.Commission on Epidemiology and Prognosis. International League Against Epilepsy // Epilepsia. – 1993. – Vol. 34. – P. 592-595.
4. Мартынов, М.Ю. Ведение пациентов с острыми нарушениями мозгового кровообращения в контексте пандемии Covid-19. Временные методические рекомендации. Версия 2. 16.04.2020 г. / М.Ю. Мартынов, Н.А. Шамалов, Д.Р. Хасанова [и др.]. – М.: Б.и., 2020. – 18 с.
5. Moriguchi, T. A first case of meningitis/encephalitis associated with SARS-Coronavirus-2 / T. Moriguchi, H. Norikazu, G. Junko [et al.] // Int. J. Infect. Dis. – 2020. – Vol. 94. – P. 55-58.
Новости неврологии. 2020. № 5, с. 2-8.


