А.И.Федин
ФГАОУ ВО Российский национальный исследовательский медицинский университет им. Н.И.Пирогова МЗ РФ
В декабре 2019 года многие необъяснимые случаи пневмонии произошли в Ухане (Китай) и быстро распространились в другие части Китая, а затем в Европу, Америку и Азию. Подтверждено, что эта вспышка вызвана новым коронавирусом (CoV) [1]. Сообщалось, что новый CoV имел симптомы, напоминающие симптомы тяжелого острого респираторного синдрома CoV (SARS-CoV) в 2003 году [2]. Оба имели один и тот же рецептор, ангиотензин-превращающий фермент 2 (ACE2) [3]. Таким образом, этот вирус был назван SARS-CoV-2, а в феврале 2020 года Всемирная организация здравоохранения (ВОЗ) назвала болезнь коронавирусом 2019 года (COVID-19) [4].
В мире в апреле 2020 г. зарегистрировано боле 3 млн. подтвержденных случаев COVID-19 и более 210 тыс. случаев смерти. При математическом прогнозе эпидемиологической ситуации распространения инфекции «Covid-19» в различных странах, проведенном Коронавирусным исследовательским центром университета Джона Хопкинса (США), в России пик заболеваемости придется на первую декаду мая, отмена режима самоизоляции – между 4-й неделей июня- и 4-й неделей июля 2020 г. (рис. 1) [5].
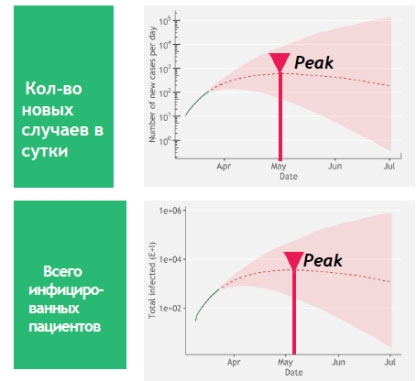
Рис. 1. Прогноз заболеваемости «COVID-19» в России. (Объяснение в тексте)
SARS-CoV-2 представляет собой оболочечный одноцепочечный РНК-вирус, который может передаваться от человека к человеку [6,7]. Летучие мыши были определены в качестве основного резервуара коронавируса в Китае [8,9]. SARS-CoV-2 примерно на 50% генетически идентичен MERS-CoV и примерно на 79% идентичен SARS-CoV, к которому он имеет сходную структуру рецептор-связывающего домена [10].
Пациенты, инфицированные вирусом, могут быть либо бессимптомными, либо иметь легкие или тяжелые клинические симптомы, такие как пневмония, дыхательная недостаточность и смерть [11]. Наиболее показательны при тяжелом течении новой коронавирусной болезни результаты РКТ-исследования легких: множественные очаговые тени и интерстициальные изменения происходят на ранних стадиях развития заболевания, в особенности в периферических зонах. Затем в обоих легких появляются множественные уплотнения по типу «матового стекла» и инфильтраты. В особо тяжелых случаях наблюдается легочная консолидация и плевральный выпот (редко)[12].
На рис. 2 приведены наиболее типичные изменения при КТ легких в результате поражения »COVID-19».
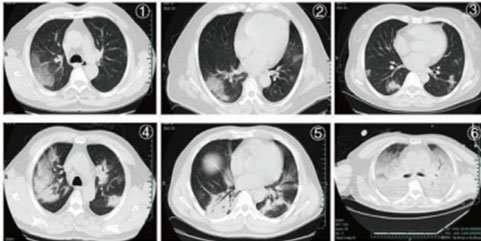
Рис. 2. Типичные изменения на КТ легких при новой коронавирусной болезни.
Установлено, что входными воротами возбудителя являются эпителий верхних дыхательных путей и эпителиоциты желудка и кишечника. Начальным этапом заражения является проникновение SARS-CoV-2 в клетки-мишени, имеющие рецепторы ангиотензин-превращающего фермента II типа (ACE2). Рецепторы ACE2 представлены на клетках дыхательного тракта, почек, пищевода, мочевого пузыря, подвздошной кишки, сердца, ЦНС. Однако основной и быстро достижимой мишенью являются альвеолярные клетки II типа (AT2) легких, что определяет развитие пневмонии [13].
Данные литературы о неврологических осложнениях при новой коронавирусной болезни немногочисленны. В публикациях, посвященных неврологическим осложнениям этой болезни, можно выделить 3 категории: проявления со стороны центральной и периферической нервной системы, а также мышечно-скелетной системы.
Церебральные осложнения «COVID-19»
Клинические проявления, связанные с центральной нервной системы, включают головную боль, головокружение, нарушение сознания, атаксию и судороги [12]. В марте 2020 г. в журнале «Radiology» был описан первый зарегистрированный случай острой некротической геморрагической энцефалопатии, связанной с COVID-19 [14]. В приведенном наблюдении женщина 50 лет, сотрудник авиакомпании, в течение 3-х дней имела повышенную температуру, кашель и изменение психического статуса (подробное описание не приводится). Анализ цепной реакции обратной транскриптазы и полимеразы в режиме реального времени выявил коронавирус-2019 (2019-нКоВ). В анализе цереброспинальной жидкости через 3 дня рост бактериальной культуры отсутствовал, тесты на вирус простого герпеса 1 и 2 типов, вирус ветряной оспы и вирус лихорадки Западного Нила были отрицательными.
На РКТ головного мозга без контрастирования выявлены очаги пониженной плотности в обоих зрительных буграх (рис.3). Церебральные артериограммы и венограммы были без патологии.
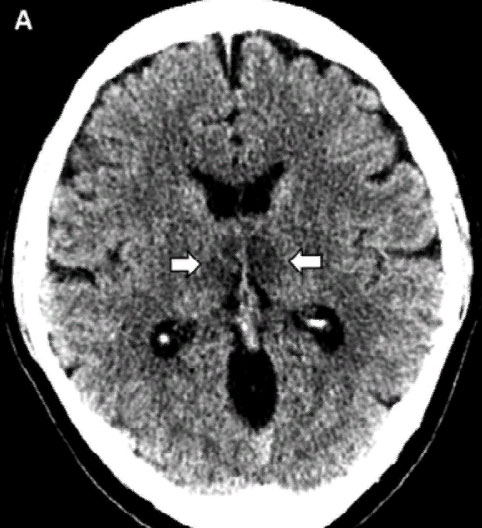
Рис. 3. РКТ головного мозга без контрастирования у больной с острой некротической энцефалопатией. Цит. Poyiadji et al., 2020. (Объяснение в тексте)
На МРТ головного мозга с контрастированием в режиме T2 FLAIR видны гиперденсивные очаги в медиальных отделах височных долей и зрительных буграх с признаками очаговых кровоизлияний (рис. 4).
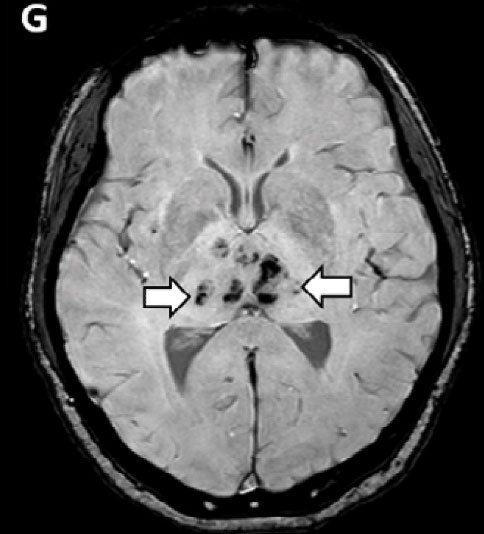
Рис. 4. МРТ головного мозга у больной с острой некротической энцефалопатией. Цит. Poyiadji et al., 2020. (Объяснение в тексте)
Выявленные при нейровизуализации очаговые поражения головного мозга авторы объяснили развитием острой некротической энцефалопатии (ОНЭ). ОНЭ является редким осложнением гриппа и других вирусных инфекций и связана с внутричерепными цитокиновыми «штормами», которые приводят к разрушению гематоэнцефалического барьера, но без прямой вирусной инвазии или параинфекционной демиелинизации [15]. ОНЭ в основном описывается в педиатрической популяции, но встречается и у взрослых. Наиболее характерная особенность визуализации включает симметричные, многоочаговые поражения с обязательным вовлечением зрительного бугра [16]. Другие часто встречающиеся локализации включают ствол мозга, белое вещество головного мозга и мозжечок [16]. Поражения проявляются гиподенсивными изображениями на РКТ и на МРТ - гиперденсивными сигналами на T2 FLAIR с внутренними кровоизлияниями. Очаги могут накапливать контраст [16].
В статье, посвященной неврологическим осложнениям «COVID-19» приводится история болезни пациента74 лет с болезнью Паркинсона, ХОБЛ, который в прошлом перенес кардиоэмболический инсульт, связанный с фибрилляцией предсердий [17]. Госпитализирован по поводу лихорадки, кашля и изменения психического статуса на пероральные антибиотики. Пациент вернулся в отделение неотложной помощи в течение 24 часов с ухудшением симптомов, включая головную боль, лихорадку и кашель. Пациент был в сознании, но вербальный контакт с ним был нарушен, инструкции не выполнял. Параличей конечностей не было. Менингеальные симптомы отсутствовали.
Тест на COVID-19 признан положительным. Рентгенография грудной клетки показала небольшой выпот в правой плевре с двусторонними помутнениями в виде «матового стекла».
На РКТ выявлялась обширная киста после перенесенного инсульта в левом полушарии мозга. В правом полушарии в лобно-височной области определялась гиподенсивная зона (рис. 5).
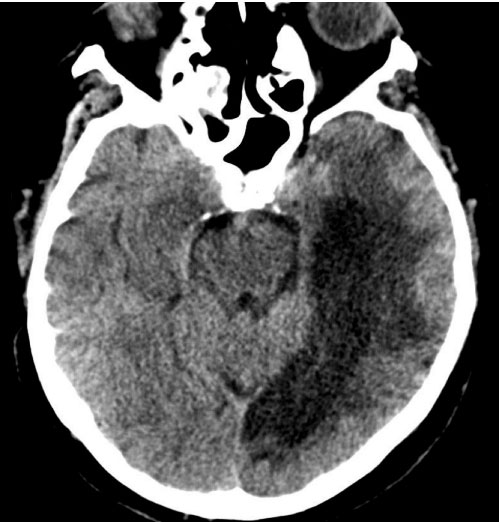
Рис. 5. РКТ головного мозга у пациента с неврологическим осложнением «COVID-19». Цит. Filatov et al., 2020.
Обозначения: на РКТ в левом полушарии определяется постишемическая киста вследствие ранее перенесенного инфаркта мозга. В правой височной области определяется зона гиподенсивного сигнала (стрелка).
МРТ головного мозга не проводилась. В спинномозговой жидкости изменений не было. Консилиум неврологов объяснил неврологический статус проявлением вирусной энцефалопатии (прим. автора – возможно у пациента развился повторный инфаркт мозга, косвенные признаки которого были на РКТ. Для уточнения диагноза необходима была нейровизуализация с МРТ).
Менингиты и энцефалиты, ассоциированные с «COVID-19».
В майском номере (2020 г.) журнала «International Jоurnal of Infectious Diseases» опубликован первый случай менингита, ассоциированного с новой коронавирусной болезнью [18].
Пациент 24 лет в конце февраля 2020 г. обратился к врачу с жалобами на слабость, головную боль и лихорадку. Врач предположил развитие гриппа и назначил ланинамивир и антипиретики. На 5-й день заболевания пациент обратился в другую клинику в связи с ухудшением состояния, прошел рентгеновское исследование грудной клетки и анализ крови на наличие коронавирусной инфекции, анализ крови оказался отрицательным. На 9-й день заболевания мужчина был найден в собственном доме лежащим на полу в бессознательном состоянии со следами рвоты. При госпитализации развились генерализованные судороги, продолжавшиеся одну минуту.
В стационаре нарушение сознания пациента было оценено в 6 баллов по шкале комы Глазго. Выявлялся менингеальный синдром. Гемодинамика была стабильной. В анализе крови регистрировался нейтрофильный лейкоцитоз с лимфопенией, высокий уровень С-реактивного белка. Цереброспинальная жидкость была бесцветной, прозрачной, в ней были обнаружены мононуклеары и полиморфонуклеарные клетки, а методом ПЦР было выявлено наличие РНК SARS-CoV-2. Анализ мазка из носоглотки при этом был отрицательным. В сыворотке крови не были обнаружены антитела типа IgM против вируса простого герпеса 1 типа и вируса ветряной оспы.
РКТ органов грудной клетки показала участки «матового стекла» в правой верхней доле и в обеих нижних долях. РКТ головного мозга острые изменения не выявила. МРТ головного мозга показала гиперденсивные участки по стенке правого бокового желудочка и изменения сигнала в правой медиальной височной доле и гиппокампе (рис. 6), что предполагало возможность развития COVID-19-ассоциированного менингита и энцефалита.
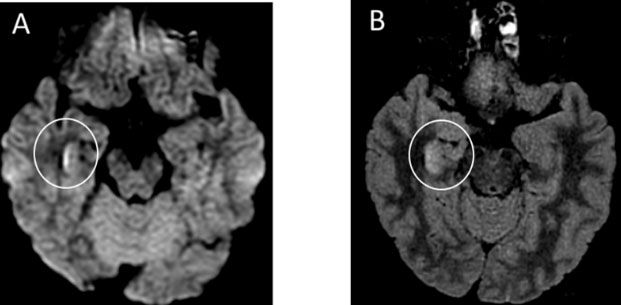
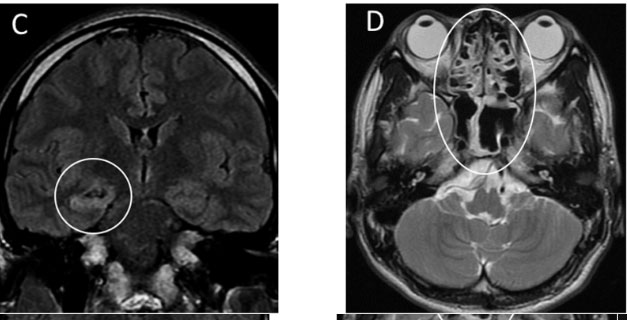
Рис. 6. МРТ головного мозга пациента с менигоэнцефалитом вследствие «COVID-19». Цит. Moriquchi et al., 2020.
Обозначения:
А. Диффузно-взвешенные изображения демонстрируют гиперинтенсивность по стенке нижнего рога правого бокового желудочка.
В, С. МРТ, изображения в режиме FLAIR показывают изменения гиперинтенсивного сигнала в правой височной доле и гиппокампе с легкой гиппокампальной атрофией. Эти находки указывают на правый боковой вентрикулит и энцефалит в основном в правом мезиальном отделе височной доли и в гиппокампе.
D. МРТ Т2-взвешенные изображения показывают пан-параназальный синусит.
Инсульты при новой коронавирусной болезни.
Опубликован ретроспективный обсервационный анализ пациентов с COVID-19, поступивших в «Union Hospital» (г. Ухань, Китай) с 16 января 2020 года по 29 февраля 2020 года [19]. Из 221 пациента с COVID-19 у 11 (5%) развился острый ишемический инсульт, у 1 (0,5%) - тромбоз венозного синуса головного мозга и у 1 (0,5%) - кровоизлияние в мозг. Пациенты с инсультом и COVID-19 были значительно старше, чем больные с тяжелым COVID-19 без инсульта (соответственно 71,6 ± 15,7 лет по сравнению с 52,1 ± 15,3 годами; p<0,05). Все больные с инсультом имели сердечно-сосудистые факторы риска, включая гипертонию, диабет и анамнез цереброваскулярных заболеваний (р <0,05). Сравнение двух групп также показало, что больные с инсультом в анализах крови имели более выраженный воспалительный ответ (С-реактивный белок в среднем равнялся соответственно 51,1 [дисперсия от 1,3 до 127,9] против 12,1 [дисперсия от 0,1 до 212,0] мг/л, р<0,01). У больных с инсультом более выраженной была гиперкоагуляция крови: D-димер (6,9 [дисперсия 0,3-20,0] против 0,5 [дисперсия 0,1-20,0] мг/л, р<0,001). По состоянию на 29 февраля 2020 года 5 пациентов (38%) с инсультом умерли.
В апреле 2020 г. в Нью-Йорке было опубликованы сведения о 5 больных с инсультом в крупной мозговой артерии в молодом возрасте [20]. У всех больных диагносцирован тяжелый острый респираторный синдром коронавирусной инфекции «COVID-19).
У ранее здоровой 33-летней женщины в течение недели были кашель, головная боль, затем у нее развились прогрессирующая, в течение 28 часов, дизартрия с онемением и слабостью в левой руке и левой ноге. При поступлении в больницу инсульт по шкале NIHSS составил 19 баллов. РКТ и РКТ-ангиография выявили ограниченный инфаркт в системе правой средней мозговой артерии с частично окклюзионным тромбом в правой общей сонной артерии в области ее бифуркации. При РКТ легких были обнаружены пятнистые помутнения в виде «матового стекла» в верхушках легких с двух сторон. Тест на вирус «COVID-19» был положительным. Была начата антиагрегантная, а потом антикоагулянтная терапия. Эхокардиография и МР-ангиография экстра- и интрацеребральных артерий не выявил источник эмболии. Повторная РКТ-ангиография на 10-й день показала полное разрешение тромба и пациентка была направлена в реабилитационный центр.
В течение двухнедельного периода с 23 марта по 7 апреля 2020 года в медицинском центре в Нью-Йорке было 5 пациентов (включая вышеупомянутого пациента) с симптомами ишемического инсульта вследствие закупорки большой артерии, которые были моложе 50 лет. Все 5 пациентов дали положительный результат на «Covid-19». Для сравнения: каждые 2 недели в течение предыдущих 12 месяцев служба этого центра лечила в среднем 0,73 пациента моложе 50 лет с инсультом в системе большой артерии головного мозга. При поступлении у 5 пациентов средний балл по шкале NIHSS составил 17, что соответствует тяжелому инсульту.
Обсуждая приведенные наблюдения, необходимо отметить, что у всех больных инсульт развился на фоне новой коронавирусной болезни. Вместе с тем, этиология инсульта полностью выяснена не была – не проводилось обследование на гемофилию, антифосфолипидный синдром, гипергомоцистеинемию, васкулиты, эти синдромы и болезни являются наиболее частыми причинами инсульта в молодом возрасте. У первой больной причиной частичного тромба в бифуркации общей сонной артерии возможна была ее диссекция, поскольку отмечался его ранний, на 10-й день, регресс. Вирусная агрессия, возможно, спровоцировала имевшееся системное заболевание.
Острые заболевания периферической нервной системы при «COVID-19»
Аносмия. Поствирусная аносмия является одной из основных причин потери обоняния у взрослых, на нее приходится до 40% общих случаев аносмии. Известны более 200 различных вирусов, вызывающих инфекции верхних дыхательных путей, что может быть причиной потери обоняния. Аносмия при предыдущих эпидемиях коронавирусами выявлялась в 10-15% случаев [22,23]. Поэтому нужны исследования, подтверждающие гипотезу, что новый вирус SARS-CoV-2 также будет вызывать аносмию у инфицированных пациентов [23].
Действительно, потеря обоняния и вкуса может быть одним из симптомов новой коронавирусной инфекции. В Китае, Южной Корее и Италии примерно треть пациентов, у которых тест на COVID-19 оказался положительным, сообщали о потере обоняния. В Германии на ухудшение обоняния жаловались двое из трех зараженных новым коронавирусом [24].
В апреле 2020 г. опубликованы результаты Европейского мультицентрового отоларинглогического исследования, изучавшего обонятельные и вкусовые дисфункции при легких и умеренных формах коронавирусной болезни «COVID-19)» [25]. В 12 Европейских госпиталях в это исследование было включено 417 пациентов с легкой и средней степенью тяжести поражения COVID-19. Наиболее распространенными общими симптомами были кашель, миалгия и потеря аппетита. Боль и заложенность носа были наиболее частыми оториноларингологическими симптомами. Соответственно 85,6% и 88,0% пациентов двух клинических форм сообщили об обонятельных и вкусовых дисфункциях. Статистический анализ выявил значительную связь между лихорадкой и аносмией (р=0,014). Обонятельная дисфункция появилась раньше других симптомов в 11,8% случаев. Раннее восстановление обонятельной дисфункции отмечена у 44,0%. 72,6% пациентов восстановили обонятельную функцию в течение первых 8 дней после разрешения заболевания.
342 пациента (88,8%) сообщили о вкусовых расстройствах, которые характеризовались нарушением следующих четырех вкусовых качеств: соленое, сладкое, горькое и кислое. Наблюдалась значительная положительная связь между обонятельными и вкусовыми дисфункциями (р <0,001). Женщины были значительно более подвержены обонятельной и вкусовой дисфункции, чем мужчины (р = 0,001).
Причиной развития аносмии в случае вирусной инфекции принято считать застойные явления в слизистой оболочке полости носа, ведущие к обструкции носовых ходов и временной потере чувствительности. В 2007 году коронавирус был обнаружен в выделениях из носа у пациентов с обонятельной дисфункцией [26]. Вместе с тем, в этом исследовании продемонстрировано, что у части пациентов обоняние не восстанавливалось. В Европейском мультицентровом исследовании обнаружено, что у 18,2% пациентов гипосмия и аносмия при «COVID-19» была без заложенности носа или ринореи [25]. В соответствии с этим высказано предположение, что воспаление слизистой носа не является единственным этиологическим фактором, лежащим в основе обонятельной дисфункции при коронавирусной инфекции. К инфицированию головного мозга SARS-CoV на ранней или поздней фазы инфекции может привести распространение COVID-19 через решетчатую кость на обонятельные тракты.
В апреле 2020 г. в журнале «Academic Radiology» был представлен случай изолированной аносмии у пациента 27 лет с новой коронавирусной инфекцией, подтвержденной методом ПЦР. Сообщается, что на МРТ обонятельных областей данного пациента интенсивность сигнала была нормальной, отсутствовали признаки застоя в носовых раковинах. Это говорит об отсутствии анатомических изменений в слизистой носа, которые мог бы вызывать вирус SARS-CoV-2, и, следовательно, нарушения обоняния возможно были обусловлены нейротропным вирусным поражением самой обонятельной системы [27].
С биомолекулярной точки зрения коронавирусы могут инфицировать периферические нейроны, используя клеточный механизм активного транспорта в центральную нервную систему [28]. В эксперименте было показано, что SARS-CoV может проникать в мозг через обонятельную луковицу и быстро распространяться через ее связи первого или второго порядка в грушевидную и инфралимбическую кору, базальные ганглии (вентральный паллидум и боковое преоптическое ядро) и дорзальный шов среднего мозга. Другие области мозга, такие, как паратениальные ядра зрительного бугра, паравентрикулярные ядра гипоталамуса и миндалевидный комплекс в эксперименте поражались в меньшей степени [29].
Синдром Гийена-Барре. В апреле 2020 г. в журнале «Lancet» был описан первый случай синдрома Гийена-Барре, ассоциированного с COVID-19 [30]. Приведена история болезни 61-летней женщины, обратившейся к врачу с жалобами на остро возникшую слабость в обеих ногах. Она вернулась из Уханя в конце января, но отрицала развитие у нее таких симптомов, как лихорадка, кашель, боль в груди и диарея. Функциональные показатели работы ее дыхательной системы были в норме, аускультация легких не выявила патологических признаков. Неврологическое обследование показало симметричную слабость (4/5 баллов по шкале оценки мышечной силы «Medical Research Council grade») и арефлексию в нижних конечностях. Симптомы прогрессировали: через три дня сила мышц составляла 4/5 для рук и 3/5 для ног. В дистальных отделах конечностей начала снижаться болевая и тактильная чувствительность. Исследование цереброспинальной жидкости на четвертый день после обращения показало нормальное количество клеточных элементов и высокий уровень белка. Проведенная на 5-й день ЭНМГ показала задержку проводимости в дистальных отделах верхних и нижних конечностей и отсутствие F-волн, что свидетельствовало о наличии демиелинизирующей полиневропатии. Женщине был поставлен диагноз: синдром Гийена-Барре.
На 8-й день у пациентки развились сухой кашель и лихорадка. РКТ органов грудной клетки показала участки «матового стекла» в обоих легких. В мазках слизи из полости носа методом ПЦР была обнаружена РНК SARS-CoV-2. После проведенного курса лечения лопинавиром и ритонавиром состояние пациентки улучшилось. На 30-й день с момента обращения восстановилась нормальная мышечная сила в руках и ногах, появились сухожильные рефлексы. У родственников, контактировавших с больной новой коронавирусной инфекцией, неврологических симптомов отмечено не было.
Авторы предполагают, что развитие синдрома Гийена-Барре у данной пациентки связано с заражением COVID-19. Но в этом наблюдении обращает внимание, что клинические, лабораторные и рентгенологические признаки заражения «COVID-19» появились спустя 8 дней после клинических симптомов полиневропатии. Не исключено в данном случае внутрибольничное заражение вирусом, а первичная этиология полиневропатии была не связана с вирусом «COVID-19».
В апреле 2020 г. в журнале «Neurology» было опубликовано сообщение о двух пациентах, инфицированных SARS-CoV-2, с полиневропатией и синдромом Миллера Фишера [31].
У первого пациента аускультация легких и сердца и обследование брюшной полости были без патологии. При неврологическом обследовании реакция зрачков на свет сохранена, зрачки симметричны. Птоза не было. Выявлялись расходящееся косоглазие правого глазного яблока, ограничения его движений внутрь и вниз, нистагм левого глазного яблока при взгляде влево. Эти результаты соответствовали правому межъядерному офтальмопарезу и парезу наружных мышц, иннервируемым правым глазодвигательным нервом. Определялись аносмия и агейзия.
Мышечная сила и мышечный тонус были нормальными во всех конечностях, нарушений чувствительности не было. Определялось отсутствие глубоких сухожильных рефлексов в верхних и нижних конечностях, походка была атактическая с широко расставленными ногами. Координаторые нарушения в верхних и нижних конечностях не выявлялись.
Нейроофтальмологическое исследование патологию не обнаружило. В крови определялись лимфопения (1000 клеток/мкл) и повышенный уровень С-реактивного белка (2,8 мг/дл). Были исследованы антитела к ганглиозидам (GM1, GM2, GM3, GD1a, GD1b, GD3, GT1a, GT1b, GQ1b и антисульфатидные антитела) в сыворотке крови. Тест был положителен только к антителу GD1b-IgG. Тест мазка на ротоглотку пациента на COVID-19 с помощью анализа обратной транскриптазы-полимеразно-цепной реакции в реальном времени был положительным. При исследовании спинномозговой жидкости ее давление было 110 мм H2O, в анализе - белок 80 мг/дл, глюкоза 62 мг/дл. Цитоза не было, серологические исследования, в том числе рРТ-ПЦР для COVID-19, были отрицательные. Рентгенография и РКТ грудной клетки были в норме.
Больному был назначено внутривенное введение иммуноглобулина 0,4 г/кг в течение 5 дней. Офтальмопарез и атаксия в последующие дни значительно улучшились, он был выписан домой через две недели с полным регрессом неврологических симптомов, за исключением остаточной аносмии и агейзии.
У второго пациента не было классического синдрома Миллера Фишера, но имелась изолированная множественная черепная невропатия, которая самопроизвольно и быстро регрессировала. По данным литературы существуют неполные формы синдрома Миллера Фишера, в том числе, острая атаксическая невропатия, которая может быть диагностирована при отсутствии офтальмоплегии, и острый офтальмопарез, который может возникать при отсутствии атаксии [28]. Возможно, краниальный полиневрит, как у второго пациента, может быть отдельным подтипом, который лежит на стыке между синдромом Миллера Фишера и синдромом Гийена-Барре.
Вслед за этой статьей в следующем номере журнала «Neurology» опубликованы два наблюдения с офтальмопарезом при «COVID-19» [29]. В первом случае у 36-летнего мужчины в анамнезе были врожденное косоглазие, левосторонний птоз, диплопия и двусторонняя дистальная парестезия в нижних конечностях. За 4 дня до госпитализации у него были лихорадка, кашель и мышечные боли. При обследовании выявлены левосторонний мидриаз, незначительное опущение левого верхнего века, ограничение движения левого глазного яблока внутрь, что соответствовало частичной невропатии левого глазодвигательного нерва. Было также ограничение движений глазных яблок кнаружи, связанное с двусторонней невропатией отводящих нервов (рис. 8, А). Отмечены гипорефлексия и гипестезия нижних конечностей, атаксия походки. Назальный мазок на ПЦР SARS-CoV-2 был положительным. МРТ регистрировала гиперинтенсивность сигнала Т2-изображения и увеличение размера левого глазодвигательного нерва (рис. 8, B-D).
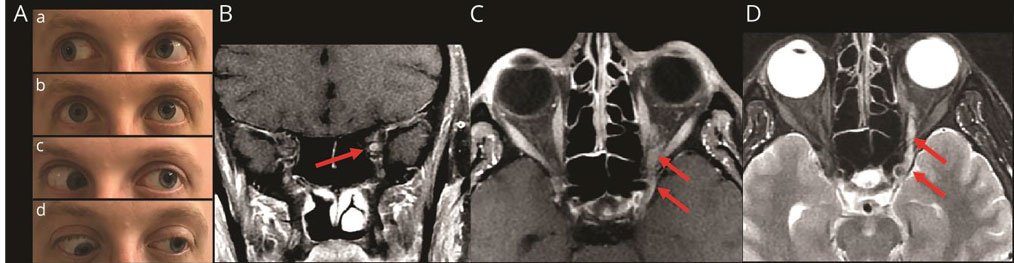
Рис. 7 (A,B,C,D). Фотографии движения глаз и МРТ больного с двусторонним офтальмопарезом и «COVID-19». Цит. Dinkin et al., 2020. (Объяснение в тексте)
Рентгенограмма легких была не изменена. На следующий день отмечалось увеличение левостороннего птоза, полное отсутствие горизонтальных движений левого глаза и отсутствие отведения правого глаза кнаружи.
Пациент получал внутривенный иммуноглобулин (2 г/кг в течение трех дней) для лечения предполагаемого синдрома Миллера Фишера и гидроксихлорохин для «COVID-19» (600 мг два раза в день в течение одного дня, затем 400 мг ежедневно в течение четырех дней). Глазодвигательные нарушения частично регрессировали через три дня после поступления. Панель ганглиозидных антител была отрицательной.
Сочетание офтальмопареза, парестезии ног и арефлексии в первом случае авторы связывают с острой демиелинизирующей воспалительной полиневропатией (синдром Миллера Фишера). Возникновение неврологических симптомов в течение нескольких дней после начала клинических проявлений вирусной агрессии подтверждает вирусную этиологию полиневропатии.
Во втором случае 71-летняя женщина с артериальной гипертонией в анамнезе за 2 дня до госпитализации после сна обнаружила диплопию и безболезненное ограничение движений правого глаза (рис. (8, E). Заболеванию в течение нескольких дней предшествовали кашель и лихорадка.
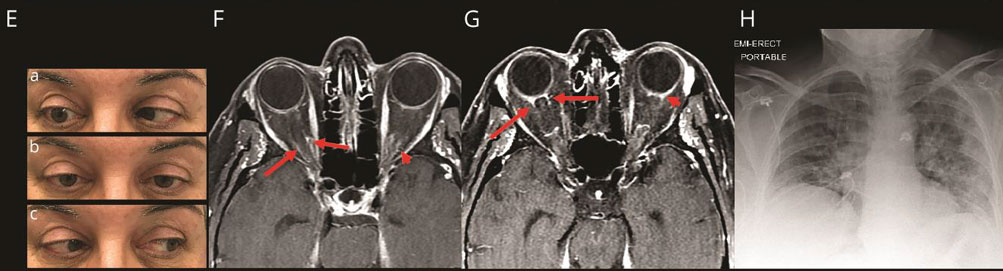
Рис. 8 (E,F,G,H). Фотографии движения глаз и МРТ больной с правосторонним офтальмопарезом и «COVID-19». Цит. Dinkin et al., 2020. (Объяснение в тексте)
Больную госпитализировали в отделение неотложной помощи. В неврологическом статусе очаговая симптоматика, кроме пареза правого отводящего нерва, отсутствовала. При обследовании острота зрения, зрачки и офтальмоскопия были в норме. Рентгенограмма грудной клетки показала двусторонние симптомы «матового стекла» (рис. 8, H). ПЦР в носовой полости для SARS-CoV-2 был положительным. При люмбальной пункции давление ликвора было 160 мм H2O, анализ ликвора без патологии. На МРТ выявлено расширение оболочек зрительных нервов и задних теноновых капсул, являющихся фасциальной оболочкой глазного яблока (рис. 8, F-G).
Для лечения коронавирусной пневмонии больной назначали гидроксихлорохин (в той же дозировке, как указано выше). Офтальмопарез до выписки оставался на прежнем уровне. Через 2 недели после выписки по телефону она сообщила о постепенном улучшении диплопии.
По мнению авторов во втором случае, хотя МРТ-доказательств поражения отводящего нерва не было, увеличение размеров оболочки зрительного нерва вовлеченного глаза может быть связано с локальным лептоменингитом вирусной этиологии. Учитывая факторы риска у больной и безболезненный характер диплопии, дифференциальный диагноз следует проводить с ишемическим процессом.
Патология мышечно-скелетной системы при «COVID-19»
Миалгия является одним и самых распространенных первичных симптомов новой коронавирусной болезни. В сообщении ВОЗ на основании анализа 56 тыс. COVID-19 в Китае показано, что мышечная боль как один из первых симптомов заболевания была в 15% случаев [4]. В проведенном мета-анализе клинических и лабораторных данных при «COVID-19», для которого было отобрано 426 публикации, выявлено, что случаи мышечной боли и усталости выявлены в 36% (95% ДИ 18% –55%, n= 3778) случаев [34]. Среди госпитализированных в г. Ухань (Китай) 214 зараженных вирусом больных мышечные боли были у 23 (10,7%) [35]. Подобный статистический разброс, возможно, объясняется различными сроками наблюдений от начала заболевания и его тяжестью.
По данным литературы коронавирусные инфекции могут вызывать вирусный миозит. Как показано, до трети пациентов, инфицированных другими коронавирусными инфекциями, проявляются миозитом и повышенным уровнем креатифосфокиназы [36] и рабдомиолизом [37]. Мышечная слабость, связанная с атрофией мышечных волокон 2 типа, обычно проявляется через 1 неделю у пациентов с тяжелым течением заболевания при постельном режиме [38]. Фактором риска развития критической миопатии является использование недеполяризующих миорелаксантов, блокирующих нервно-мышечную передачу, которые используются при искусственной вентиляции легких у больных с тяжелым острым респираторным синдромом и пневмонией [39].
Особенности и тяжесть поражения мышечно-скелетной системы связаны со степенью дыхательных расстройств, состоянием гемодинамики и нарушением функции ствола головного мозга, а также наличием сопутствующих нервно-мышечных болезней [38]. К ним относятся пациенты с болезнями двигательных нейронов (боковым амиотрофическим склерозом, спинально-мышечной атрофией), наследственными невропатиями с поражением дыхательных мышц, метаболические митохондриальные миопатиии, метаболические заболевания (например, болезнь Помпе, при которой имеется слабость дыхательных мышц или кардиомиопатия) [40]. Эти пациенты, инфицированные COVID-19, подвержены повышенному риску развития тяжелой формы ХОБЛ-19 и могут не вернуться к своему предыдущему своему состоянию [40].
В настоящее время нет прямых доказательств непосредственного поражения мышц при COVID-19. При электронно-микроскопическом исследовании мышц, проведенном у умерших больных с SARS, вирусные частицы в них отсутствовали. Наиболее типичным при патогистологическом исследовании был очаговый некроз миофибрил. На основании этого было предложена гипотеза о иммуноопосредованном повреждении мышечных волокон [41].
Таким образом, поражения центральной и периферической нервной системы, а также мышечно-скелетной системы при заражении «COVID-19» полиморфны по клинической симптоматике. При исследовании 214 пациентов с новой коронавирусной болезни в г. Ухани (Китай) было отмечено, что более 36,4% из них имели неврологические симптомы, чаще у пациентов с тяжелой течением инфекции [11].
Представляют интерес патогенетические механизмы, которые могут объяснить неврологические нарушения при заражении «COVID-19». Как было показано выше, начальным этапом заражения является проникновение SARS-CoV-2 в клетки-мишени, имеющие рецепторы ангиотензин-превращающего фермента II типа (ACE2). Распределение коронавируса в тканях человека и возможный механизм его нейротропизма показаны на рис. 9.
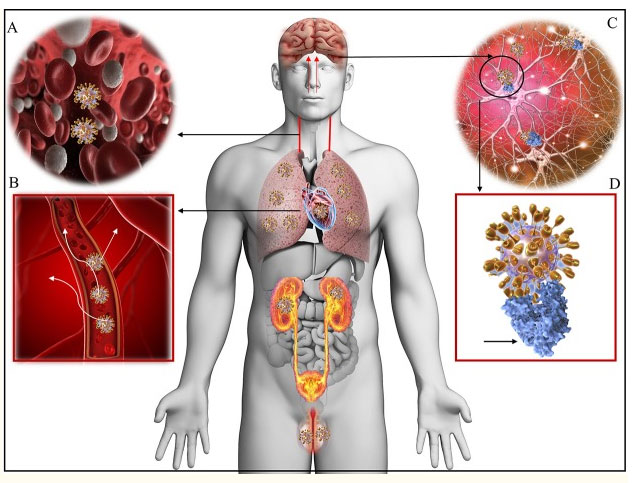
Рис. 9. Распределение рецепторов ACE2 в тканях человека. Цит. Baig et., 2020.
Как представлено на рис. 9, вирусемия (A) распространяет вирус COVID-19 по всему организму через кровоток (B). Нейротропизм вируса может возникать посредством циркуляции и / или транскрипционного пути через верхнюю носовую раковину, который позволяет COVID-19 проникать в головной мозг (C) и связываться с рецепторами ACE2 (D, синий цвет). COVID-19 стыкуется с белком рецептора ACE2 с помощью белка-шипа (D, золотые шипы). На рис. 9 показаны легкие, сердце, почки, кишечник, мозг и яички, которые экспрессируют рецепторы ACE2 и являются возможными мишенями для COVID-19 [42]. Белок-шип является основным поверхностным белком, который коронавирус использует для связывания с белком рецептора. После того, как белок-шип связывается с рецептором клетки человека, вирусная мембрана сливается с мембраной клетки человека, позволяя геному вируса проникнуть в клетки человека и начать инфицирование [43].
Наряду с гематогенным распространением коронавируса обсуждаются и другие возможные пути нейроинвазии SARS-CoV-2, в том числе прямая вирусная инвазия головного мозга. Это предположение высказано после того, как группа врачей Пекинской больницы «Дитан» подтвердила наличие SARS-CoV-2 в спинномозговой жидкости пациентов с COVID-19 путем секвенирования генома [44]. При нейровизуализации показана возможность проникновения коронавируса в обонятельную систему головного мозга, минуя слизистую носа [27].
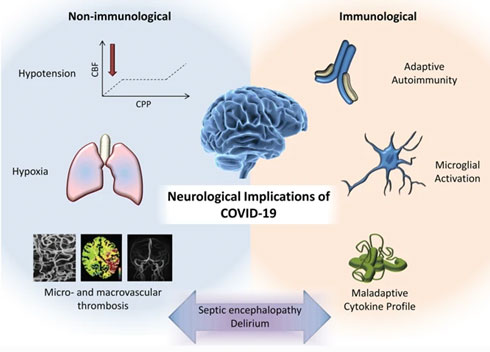
Рис. 10. Возможные механизмы неврологических осложнений «COVID-19». Цит. Needham., 2020.
На рис. 10 показаны возможные механизмы неврологических осложнений после заражения «COVID-19» [45]. Как видно на рис. 10, эти механизмы могут быть не связаны или связаны с иммунной системой. При первом варианте вполне понятным является поражение головного мозга при снижении системной гемодинамики и гипоксии, которые развиваются при тяжелом течении острого респираторого стресс-синдрома и обширной двусторонней пневмонии. Приводится мнение, что развивающаяся при гипоксии дисфункция ствола головного мозга может в свою очередь быть причиной ухудшения функционирования легких и прогрессирования острого респираторного стресс-синдрома [46]. Вторичные церебральные осложнения могут проявляться при системной эндотельиальной дисфункции вследствие взаимодействия белка шипа вируса SARS-CoV-2 с ACE2 в капиллярном эндотелии. Последующее выделение вирусных частиц из капиллярного эндотелия и повреждение эндотелиальной выстилки также могут способствовать вирусному доступу к мозгу [47]. Несомненное значение имеет нарушение микрогемоциркуляции, в том числе и церебральной, возникающее при нарушении функции сосудистого эндотелия.
Как отмечалось во многих эпидемиологических исследованиях, особенностью пандемии новой коронавирусной болезни является преобладание в популяции больных старших возрастных групп [4,5], при этом сообщается об артериальной гипертонии, сердечно-сосудистых заболеваниях и диабете как наиболее частых коморбидных заболеваниях у пациентов с COVID-19 [48]. Общей чертой всех этих расстройств является эндотелиальная дисфункция. COVID-19 увеличивает эндотелиальную патологию, что объясняет основные ее системные проявления, включая гиперкоагуляцию и тромботические осложнения [49]. Эти факторы могут быть причиной цереброваскулярных осложнений, в том числе инсультов, особенно у больных с имевшимися ранее сосудистыми факторами риска.
Определяющим для клинических проявлений и течения новой коронавирусной болезни является участие в патологическом процессе иммунной системы (рис. 10). Фундаментальным для разрешения COVID-19Э может считаться эффективный иммунный ответ против SARS-CoV-2 [50].. Некоторые исследования выявили значительную взаимосвязь между тяжестью заболевания и уровнем провоспалительных цитокинов и подмножеств иммунных клеток [51, 52]. Предполагается, что во время реакции на SARS-CoV-2 иммунная дисрегуляция и высокий уровень провоспалительных цитокинов, который получил название «цитокиновый шторм», могут быть основными причинами повреждения тканей [50].
Это предположение нашло подтверждение в ряде исследований. При изучении 48 цитокинов в образцах плазмы 53 случаев заражения COVID-19, среди которых 34 случая были тяжелыми, а остальные - средней степени тяжести, было выявлено, что уровни 14 цитокинов в случае заражения COVID-19 были значительно выше нормы. Уровни цитокинов IP-10, MCP-3 и IL-1ra были значительно выше в тяжелых случаях и тесно связаны с показателями парциального содержания кислорода в артериальной крови, ухудшением течения заболевания и летальным исходом [53].
Заключение. Представленный обзор литературы, посвященный неврологической патологии у больных с COVID-19, показывает, что неврологические осложнения полиморфны по своей симптоматике и тяжести клинических проявлений. Рассматриваются как прямое нейротропное действие вируса, так и вторичные механизмы неврологических осложнений, связанных с системными поражениями. Подчеркивается большая роль гипериммунных реакций и воспаления в патогенезе новой коронавирусной болезни. Несомненное значение имеют предшествующие заболевания с коморбидной патологией.
Литература
1. Zhu N. , Zhang D. , Wang W. et al. China Novel Coronavirus Investigating and Research Team. A novel coronavirus from patients with pneumonia in China. N Engl J Med. 2020;382(8):727-733. DOI:10.1056/NEJMoa2001017.
2. Zhou P. , Yang XL. , Wang XG. , et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020;579(7798):270-273. DOI:10.1038/s41586-020-2012-7.
3. Zhao Y. , Zhao Z. , Wang Y. et al. Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov. bioRxiv. 2020. DOI:10.1101/2020.01.26.919985.
4. World Health Organization. Coronavirus disease 2019 (COVID-19) situation report-45. Accessed March 5, 2020. https://www.who.int/docs/defaultsource/coronaviruse/situation-reports/20200305-sitrep-45-covid19.pdf?sfvrsn=ed2ba78b_2.
5. John Hopkins University (Coronavirus Resource Center). Euromonitor. BCG Analysis. 23 March.2020.
6. Chan, J.F.-W., Yuan, S., Kok, K.-H. et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: A study of a family cluster. Lancet 2020, 395, 514–523.
7. Xu, X., Chen, P., Wang, J. et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci. China Life Sci. 2020, 63, 457–460.
8. Hu B., Zeng L., Yang X. et al. Discovery of a rich gene pool of bat SARS-related coronaviruses provides new insights into the origin of SARS coronavirus. PloS Pathog. 2017, 13, e1006698.
9. Li W., Shi Z., Yu M. et al. Bats are natural reservoirs of SARS-like coronaviruses. Science 2005, 310, 676–679.
10. Lu R., Zhao X., Li J. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: Implications for virus origins and receptor binding. Lancet 2020, 395, 565–574.
11. Yang X., Yu Y., Xu J. et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: A single-centered, retrospective, observational study. Lancet Respir. Med. 2020.
12. Руководство по профилактике и лечению новой коронавирусной инфекции COVID-19. Под ред. проф. Тинбо Лян. Пер. с англ. М.2020.
13. Профилактика, диагностика и лечение новой коронавирусной инфекции «COVID-19». Министерство здравоохранения РФ. Временные методические рекомендации. Версия 6. 28.4.2020 г.
14. Poyiadji N., Shahin G., Noujaim D. et al. COVID-19–associated Acute Hemorrhagic Necrotizing Encephalopathy: CT and MRI Features. Radiology. 2020. March. https://DOI.org/10.1148/radiol.2020201187.
15. Rossi A. Imaging of acute encephalomyelitis. Neuroimaging Clinics. 18 (1):149-161.
16. Wong F., Simon E., Zimmerman R. et al. Acute necrotizing encephalopathy of childhood: correlation of MR findings and clinical outcome. AJNR. 2006; 27 (9): 1919-1923.
17. Filatov A., Sharma P., Hindi F. et al. Neurological Complications of Coronavirus Disease (COVID-19): Encephalopathy. Cureus 12(3): e7352. DOI:10.7759/cureus.7352.
18. Moriquchi T., Harii N., Goto J. et al. A first of meningitis/encephalitis associated with SARS-Coronavirus-2. International J0urnal of Infectious Diseases. 2020. V.94:54-58.
19. Li Y., Wang M., Zhou Y. et al. Acute Cerebrovascular Disease Following COVID-19: A Single Center, Retrospective, Observational Study. J. of Stroke. 2020. April 17 (in press 104881).
20. Young K. COVID-19: Stroke in Young Adults /New Presentation in Kids/ ACS Advissions. The New England Yournal of Medicine. 2020/ April 28. DOI: 10.1056/NEYMc2009787.
21. Majersik J., Reddy V. Acute neurology during tye COVID-19 pandemic: Supporting the front line. DOI: 10.1212/WNL.0000000000009564.
22. Ceccarelli M., Berretta M., Rullo E. et al. Differences and similarities between Severe Acute Respiratory Syndrome (SARS)- CoronaVirus (CoV) and SARS-CoV-2. Would a rose by another name smell as sweet? Eur Rev Med Pharmacol Sci 2020;24:2781-2783.
23. Keyhan S., Fallahi R., Cheshmi B. Dysosmia and dysgeusia due the novel 2019 novel Coronavirus: a hypothesis that needs further investigation. Maxyllofacial Plastic and Resonsctructive Surgery 2020;42.
24. Machado С., Gutierrez J. Anosmia and Ageusia as Initial or Unique Symptoms after SARS-COV-2 Virus. Preprints. Posted: 16 April 2020. DOI: 10.20944/preprints202004.0272.v1.
25. Lechien J., Chiesa-Estomba C., De Stati D. et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur.Arch. Otorhinolaryngol. 2020. Apr. 6. DOI: 10.1007/s00405-020-05965-1.
26. Suzuki M., Saito K., Min WP. et al. Identification of viruses in patients with postviral olfactory dysfunction. Laryngoscope. 2007;117(2):272–277. DOI: 10.1097/01.mlg.0000249922.37381.1e.
27. Galougahi M., Ghorbani J., Bakhshayeshkaram M. et al. Olfactory Bulb Magnetic Resonance Imaging in SARS-CoV-2-Induced Anosmia: The First Report. Acad.Radiol. 2020. Apr 11. DOI: 10. 1016/j.acra.2020.04.002.
28. Koyuncu O., Hogue I., Enquist L. Virus infections in the nervous system. Cell Host Microbe. 2013;13(4):379–393. DOI: 10.1016/j.chom.2013.03.010.
29. Netland J., Meyerholz D., Moore S. et al. Severe Acute Respiratory Syndrome Coronavirus Infection Causes Neuronal Death in the Absence of Encephalitis in Mice Transgenic for Human ACE2. J. of Virology. Aug. 2008:7264-7275. DOI: 10.1128/JVI.00737-08.
30. Zhao H., Shen D., Zhou H. et al. Guillen-Barre syndrome associated with SARS-CoV-2 infection: causality or coincidence? The Lancet. 2020/ V.19. N.5:383-384.
31. Gutierrez C., Mendez A., Rodrigo-Rey S, et al. Miller Fisher Syndrome and polyneuritis cranialis in COVID-19. Neurology. 2020. April 17. DOI: .org/10.1212/WNL.0000000000009619.
32. Wakerley BR, Uncini A, Yuki N. Guillain-Barre and Miller Fisher syndromes-new diagnostic classification. Nature reviews Neurology 2014;10:537- 544.
33. Dinkin M., Gao V., Kahan J. et al. COVID-19 presenting with ophthalmoparesis from cranial nerve palsy. Neurology, 2020. May 1 (in press). DOI: 10.1212/WNL.0000000000009700.
34. Junior I., Nascimento B., Cacic N. et al. Novel Coronavirus Infection (COVID-19) in Humans: A Scoping Review and Meta-Analysis. J Clin Med. 2020 Mar 30;9(4). DOI: 10.3390/jcm9040941.
35. Mao J., Jin H., Wang M. et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. April 10, 2020. DOI: 10.1001/jamaneurol.2020.1127.
36. Fan CK., Yieh KM,, Peng MY. et al. Clinical and laboratory features in the early stage of severe acute respiratory syndrome. J Microbiol Immunol Infect 2006;39:45-53.
37. Chen LL., Hsu CW., Tian YC. et al. Rhabdomyolysis associated with acute renal failure in patients with severe acute respiratory syndrome. Int J Clin Pract 2005;59: 1162-1166.
38. Guidon A., Amato A. COVID-19 and neuromuscular disordes. Neurology. 2020. 94:1-11. DOI: 10.1.212/WNL.00000000009566.
39. Torbic H., Duggal A. Neuromuscular blocking agents for acute respiratory distress syndrome. J Crit Care 2019;49:179-184.
40. Association of British Neurologists. Association of British Neurologists guidance on COVID-19 for people with neurological conditions, their doctors and carers. Published March 22, 2020. Available at: https://cdn.ymaws.com/www.theabn.org/resource/collection/6750BAE6-4CBC4DDB-A684-116E03BFE634/ABN.Neurology.COVID-19.Guidance.22.3.20.pdf. Accessed on April 9, 2020.
41. Leung TW., Wong KS., To KF. et al. Myopathic changes associated with severe acute respiratory syndrome: a postmortem case series. Arch Neurol. 2005 Jul;62(7):1113-7.
42. Baig AM., Khaleeq A., Ali U. et al. Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chem Neurosci. 2020 Apr 1;11(7):995-998. DOI: 10.1021/acschemneuro.0c00122.
43. Saplakoglu Y. Coronavirus 'spike' protein just mapped, leading way to vaccine. Live Science. February 19, 2020.
44. Guo Y., Cao Q., Hong Z. et al. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status. Mil Med Res. 2020, 7:11. 10.1186/s40779-020-00240-0.
45. Needham E., Chou S., Coles A. et al. Neurological Implications of COVID-19 Infections. Neurocritical Care. April 28, 2020.
46. Machado C., Gutierrez J. Brainstem dysfunction SAR-COV-2 infection can be a potentional cause of respiratory distress (Review article). Preprint. April 2020. DOI: 10.20944/preprints202004.0330.v1.
47. Wu Y., Xu X., Chen Z., et al. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun. 2020; DOI: 10.1016/j.bbi.2020.03.031.
48. Shi S., Qin M., Shen B. et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020; in press.
49. Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844-847.
50. Tufan A., Guler A., Matucci-Cernic M. COVID-19, immune system response, hyperinflammation and repurposing antirheumatic drugs. Turk J Med Sci. 2020; 50(3): 620–632. DOI: 10.3906/sag-2004-168.
51. Yang J., Shen C., Li J. et al. Exuberant elevation of IP-10, MCP-3 and IL-1ra during SARS-C oV-2 infection is associated with disease severity and fatal outcome. http://relaxandoint.ru/air. DOI: org/10.1101/2020.03.02.20029975.
52. Wan S Yi Q Fan S Lv J Zhang X Characteristics of lymphocyte subsets and cytokines in peripheral blood of 123 hospitalized patients with 2019 novel coronavirus pneumonia (NCP) MedRxiv. 2020;10.
53. Lahiri D., Ardila A. COVID-19 Pandemic: A Neurological Perspective. . Cureus 12(4): e7889. doi:10.7759/cureus.7889.
